
科目: 来源: 题型:
【题目】下列化学用语和化学符号使用正确的是
A.次氯酸的结构式可以表示为:H—O—Cl
B.乙醇的结构简式为:C2H6O
C.含58个质子和82个中子的铈(Ce)原子符号为:![]() Ce
Ce
D.硫化钠的电子式:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中不属于化合、分解、置换、复分解等四种基本反应类型的是( )
A.CuSO4+H2S=CuS↓ + H2SO4
B.2FeCl3+Cu=2FeCl2+CuCl2
C.Cu2(OH)2CO3 ![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关气体体积的叙述正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积指1mol任何气体所占的体积约为22.4L
查看答案和解析>>
科目: 来源: 题型:
【题目】两种常见的非金属元素A与B,与常见的三种金属元素C、D、E,A的一种单质是自然界硬度最大的物质,B与C的单质在加热条件下反应生成淡黄色化合物X,D的单质既能与盐酸、也能与NaOH溶液反应生成H2。E的单质在B的单质中燃烧火星四溅,生成一种黑色固体Y。请回答下列问题:
(1)物质X的名称__________________。![]()
![]()
![]()
(2)将D的单质用砂纸打磨,然后灼烧,液态的D并不滴落的原因_____________________
(3)写出E的单质与H2O加热时反应的化学方程式,并用单线桥分析电子转移的方向和数目:________________________________________________________。
(4)ag C的单质投入足量CuSO4溶液中,下列实验现象正确的有__________________。
A.钠沉在溶液底部 B.熔化成银色光亮的小球
C.小球四处游动发出”嘶嘶”的声音 D.生成红色固体物质
可能的离子方程式为___________________________________________________。将所得沉淀过滤、洗涤、灼烧,可得到___________g固体。
查看答案和解析>>
科目: 来源: 题型:
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下图:
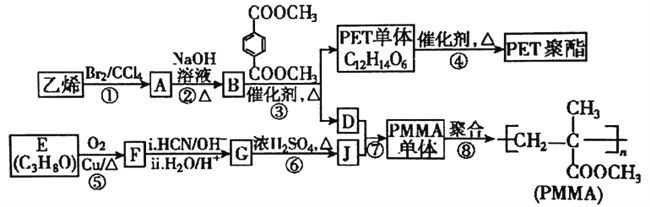
已知:
I.RCOOR+R "OH![]() RCOOR "+ROH (R.R'、R"代表烃基)
RCOOR "+ROH (R.R'、R"代表烃基)
II.  (R代表烃基)。
(R代表烃基)。
(1)PMMA单体的结构简式为_______,PET单体中的官能团名称为________。
(2)反应⑤的反应类型是________;反应②的化学方程式为_________。
(3)若反应④得到的某一条链状产物聚合度为n,则缩聚反应中脱去的小分子有(___)个。
(4)PMMA单体有多种同分异构体,某种异构体K具有如下性质:①不能发生银镜反应②不能使溴水褪色③分子内没有环状结构④核磁共振氢谱有面积比为3:1的两种峰,则K的结构简式为:__________;另一种异构体H含有醛基、羟基和碳碳双键,在铜催化下氧化,官能团种类会减少一种,则H合理的结构共有___种(不考虑立体异构和空间异构)。
查看答案和解析>>
科目: 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃(含SiO2、Fe2O3、CeO2、FeO等物质)。某小组以此废玻璃为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4。
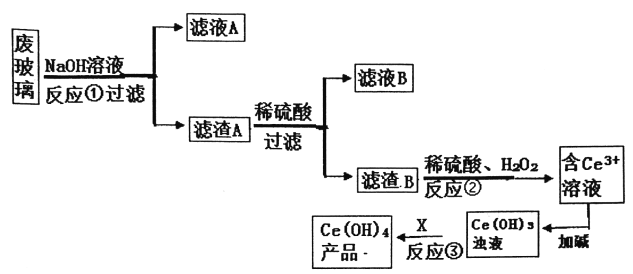
己知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有强氧化性。
(1)废玻璃在NaOH溶液浸洗前往往要进行的操作________,反应①的离子方程式_______。
(2)反应②的离子方程武是____________。
(3)为了得到较纯的Ce3+溶液,反应②之前要进行的操作是______。
(4)反应③需要加入的试剂X可以是_________。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
![]()
用FeSO4溶液滴定用_____做指示剂,滴定终点的现象_______若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数____(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.ClO2 是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得 ClO2:2KClO3+H2C2O4+H2SO4 ═ 2ClO2↑+K2SO4+2CO2↑+2H2O,试回答下列问题。
(1)该反应中还原剂的化学式是 __________;被还原元素的元素符号是 _________ ;
(2)试比较 KClO3 和 CO2 的氧化性强弱 ____________________________________;
(3)消毒时,ClO2 还可以将水中的 Fe2+ 、 Mn2+ 等转化成 Fe(OH)3 和MnO2 等难溶物,此过程说明 ClO2 具有 ___________ ( 填“氧化”或“还原” ) 性;
(4)当转移 0.2mol 电子时,生成的ClO2在标准状况下的体积为 ___________________。
Ⅱ.根据已学知识回答下列问题:
(1)在反应 KIO3 + 6HI==3I2 + KI + 3H2O中,氧化剂与还原剂的物质的量之比为________。
(2)2FeS+ 6H2SO4(浓)![]() Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为______
Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为______
(3)配平下面两个反应:
① ____H2O + ____Cl2 +____ SO2 ==____H2SO4 + ____HCl
② ____KMnO4 + ____HCl==____KCl + ____MnCl2 + ____Cl2↑ + ____H2O(系数是1的也请填上)
根据以上两个反应反应,写出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 这六种物质组成的氧化还原反应的方程式并配平:______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断回答下列问题:
(1)f在周期表中的位置是__________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):_______>__________;________比较g、h的最高价氧化物对应水化物的酸性强弱:_______>__________。____________
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:_________________。
(4)写出e的单质在足量d2中燃烧反应的化学方程式:____________________________。
(5)上述元素可组成盐R:zx4f(gd4)2。向盛有10 mL 1 mol·L-1R溶液的烧杯中逐滴加入1 mol·L-1NaOH溶液,沉淀的物质的量随加入NaOH溶液体积的变化示意图如下:
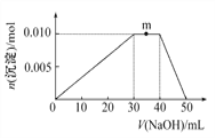
①写出m点反应的离子方程式:____________________________。
②若在R溶液中改加20 mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】①将0.100 L 1.00 mol·L-1的纯碱溶液逐滴滴入0.100 L 1.25 mol·L-1的盐酸中;②将0.100 L 1.25 mol·L-1的盐酸逐滴滴入0.100 L 1.00 mol·L-1的纯碱溶液中;两种操作产生CO2的体积比为
A. 5∶2 B. 2∶5 C. 2∶1 D. 1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E、F六种有机物,它们的转化关系如图所示(图中部分反应条件及生成物没有全部写出).已知:液体B能发生银镜反应,气体D的相对分子质量为28.
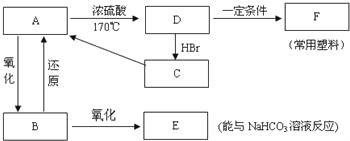
(1)A、B、C的结构简式分是 、 、 .
(2)B、C中所含官能团的名称分别是 、 .
(3)A到D的反应类型为 .
(4)C→A的反应条件是 .
(5)D→F反应的化学方程式是 .
(6)在一定的条件下,A与E反应可生成一种具有香味的物质.该反应的化学方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com