
科目: 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是

A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
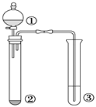
选项 | ① | ② | ③ | 实验结论 |
A | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 氯气具有酸性、漂白性 |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:N>C>Si |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化剂和还原剂在生产生活中广泛使用。
(1)H3PO2均可将溶液中的 Ag+还原为 Ag,从而可用于化学镀银。
①H3PO2中P元素的化合价为___。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂物质的量之比为4:1,则氧化产物为___。
(2)氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,反应的化学方程式为8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O。根据题意完成下列小题:
①该反应的还原产物是___(填化学式);
②所得混合气体的平均相对分子质量为___。
(3)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3-、MnO4-、IO4-。
①有关反应的离子方程式为___。
②在锰离子转化为高锰酸根离子的反应中,如果把反应后的溶液稀释到1L,测得溶液的c(H+)=0.03mol/L,则在反应中转移电子的物质的量为___mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家研制出的新型高效光催化剂能利用太阳能分解水制取氢气,主要过程如图所示,下列说法正确的是( )
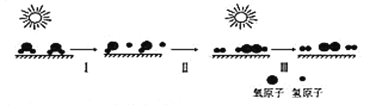
A. 与电解相比,光解水过程中消耗的能量较低
B. 过程I、Ⅱ都要吸收能量
C. 过程Ⅱ既有极性键形成,又有非极性键形成
D. 利用膜分离技术分离氢气和氧气具有良好的应用前景
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
B. 100g CaCO3晶体和100g KHSO4晶体中含有的离子数分别为2NA和3NA
C. 标准状况下,4.48L NO和2.24L O2混合后,原子总数为0.6NA
D. 已知3BrF3 + 5H2O=HBrO3 + Br2 + 9HF + O2↑,若有5mol H2O参加反应,则被水还原的BrF3分子数目为2NA
查看答案和解析>>
科目: 来源: 题型:
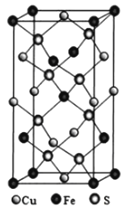
【题目】据《自然·通讯》(Nature Communications)报道,我国科学家发现了硒化铜纳米催化剂在二氧化碳电化学还原法生产甲醇过程中催化效率高。铜和硒等元素化合物在生产、生活中应用广泛。
请回答下列问题:
(1)基态硒原子的价电子排布式为________;硒所在主族元素的简单氢化物中沸点最低的是________。
(2)电还原法制备甲醇的原理为2CO2+4H2O![]() 2CH3OH+3O2。
2CH3OH+3O2。
①写出该反应中由极性键构成的非极性分子的结构式________;
②标准状况下,V L CO2气体含有________个π键。
(3)苯分子中6个C原子,每个C原子有一个2p轨道参与形成大π键,可记为(π![]() 右下角“6”表示6个原子,右上角“6”表示6个共用电子)。已知某化合物的结构简式为
右下角“6”表示6个原子,右上角“6”表示6个共用电子)。已知某化合物的结构简式为![]() ,不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,可表示为_______,Se的杂化方式为________。
,不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,可表示为_______,Se的杂化方式为________。
(4)黄铜矿由Cu+、Fe3+、S2-构成,其四方晶系晶胞结构如图所示。则Cu+的配位数为________;若晶胞参数a=b=524pm,c=1032pm,用NA表示阿伏加德罗常数的值,该晶系晶体的密度是________g·cm-3(不必计算或化简,列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碲化钠(Na2Te)可用作有机合成试剂及缩合反应中的催化剂。以碲铅矿(主要成分为PbTe)和粗盐(含CaCl2、MgCl2及一些硫酸盐、泥沙)为原料制备碲化钠的工艺流程如下:
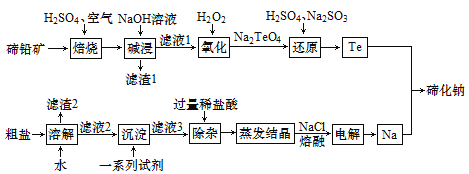
回答下列问题:
(1)Na2TeO4中Te的化合价为___。
(2)“沉淀”步骤中一系列试剂均过量,这些试剂依次包括_____(填化学式)和NaOH。
(3)“蒸发结晶”时用到的主要仪器有铁架台(带铁圈)、酒精灯、坩埚钳、_____等。
(4)已知“焙烧”后,碲主要以TeO2形式存在,“焙烧”反应的化学方程式为____。
(5)依据“氧化”“还原”两步反应可判知Na2TeO4、H2O2和Na2SO4氧化性由强到弱的顺序为___;“还原”步骤中,还原剂与氧化剂的物质的量比为_______。
(6)若制得8.7kg碲化钠,理论上电解产生标准状况下氯气的体积为______升。
查看答案和解析>>
科目: 来源: 题型:
【题目】铬、钼(Mo)、钨(W)都是第ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。回答下列问题:
(1)铬元素的最高化合价为_________;基态钼原子的核外电子排布类似于基态铬原子,则基态钼原子核外有_________个未成对电子;基态钨原子的核外电子排布是“洪特规则”的例外,则基态钨原子价电子层的电子排布图为____________________。
(2)钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
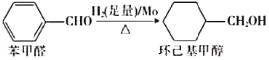
①苯甲醛分子中最多有_________________个原子共平面。
②环己基甲醇分子中采取sp3杂化的原子是_____________(写元素符号)。
(3)铬离子(Cr3+)能形成多种配合物,例如[Cr(OH)3(H2O)(H2NCH2CH2NH2)]。
①已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,Cr3+的配位数为______。
②上述配合物中,非金属元素的电负性由小到大的顺序为____________。
(4)铬的一种氧化物的晶胞结构如图所示。
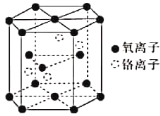
①该氧化物的化学式为____________________。
②已知六棱柱底边边长为acm,高为bcm,阿伏加德罗常数的值为NA,该晶体的密度为___________gcm-3(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中A、B属于盐,C属于碱,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)C的化学式为___。
(2)A溶液与B溶液反应可生成气体,则该反应的离子方程式为___。
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸。
①B的化学式为___,鉴别溶液中B的阴离子的试剂为___。
②D溶于稀硝酸的离子方程式为___。
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为VL,则E在混合物中的质量分数的表达式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】人们对苯及芳香烃的认识有一个不断深化的过程。
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为C6H6的一种含2个三键且无支链的不饱和链烃的结构简式:______________________________。
(2)已知分子式为C6H6的结构有多种,其中的两种结构简式为
(I)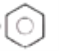 (II)
(II)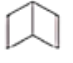
①这两种结构的区别表现在:
定性方面(即化学性质方面):Ⅱ能______________(填标号,多选不给分),而Ⅰ不能。
a.被酸性高锰酸钾溶液氧化 b.与溴水发生加成反应
c.与溴发生取代反应 d.与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1mol C6H6与H2加成时:Ⅰ需______________mol,而Ⅱ需________________mol。
②今发现C6H6还可能有另一种立体结构(如图所示)。该结构的一氯代物有____________种。二氯代物有_____________种。
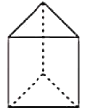
(3)萘也是一种芳香烃,它的分了式是C10H8,请你判断,它的结构简式可能是下列中的____(填标号)。
a. ![]() b.
b. 
c. ![]() d.
d. 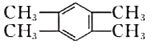
(4)根据第(3)小题中你判断得到的萘结构简式,它不能解释萘的下列________事实(填标号)。
a.萘不能使溴水褪色 b.萘能与H2发生加成反应
c.萘分子中所有原子在同一平面上 d.一溴代萘(C10H7Br)只有两种
(5)现代化学认为萘分子中碳碳之间的键是一种____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com