
科目: 来源: 题型:
【题目】(有机化学基础)丹参酸可用于药理实验、活性筛选等,合成丹参酸的路线如图所示:
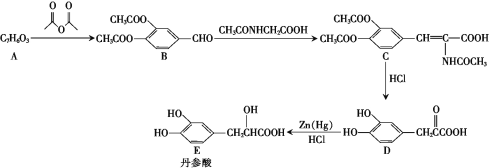
已知:ROH+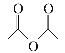
![]() ROOCCH3+CH3COOH
ROOCCH3+CH3COOH
RCH2CHO+R'CH2CHO![]()
![]()
![]()
![]()
回答下列问题:
(1)A的名称是____,B中官能团的名称是_______。
(2)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子,上述有机物中含有手性碳原子的有机物为_____(填“A”“B”“C”“D”或“E”)。
(3)D→E的反应类型是_______。
(4)A→B的化学方程式为________。
(5)X与 D互为同分异构体,请写出满足下列条件的X的结构简式:_______。
①1 mol X 能与5 mol NaOH发生反应;
②有5个碳原子在同一条直线上;
③与FeCl3溶液可以发生显色反应。
(6)设计以![]() 、CH3CHO为原料制取
、CH3CHO为原料制取![]() 的合成路线__________(其他无机试剂任选)。
的合成路线__________(其他无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温恒容条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g),若将1 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数不可能为a的是
2NH3(g),若将1 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数不可能为a的是
A. 2 mol NH3B. 1 mol N2、3 mol H2和2 mol NH3
C. 0.5 mol N2、1.5 mol H2和1 mol NH3D. 0.1 mol N2、0.3 mol H2和1.8 mol NH3
查看答案和解析>>
科目: 来源: 题型:
【题目】已知4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
A.4v(NH3)=5v(O2)B.5v(O2)=6v(H2O)
C.2v(NH3)=3v(H2O)D.4v(O2)=5v(NO)
查看答案和解析>>
科目: 来源: 题型:
【题目】(物质结构与性质)元素周期表中第57号元素镧到71号元素镥这15种元素统称为镧系元素。回答下列问题:
(1)钬(Ho)可用来制作磁性材料,其基态原子电子排布式为[Xe]4f116s2,钬(Ho)有___个未成对电子。
(2)钇钡铜氧(YBa2Cu3O7-x)是一种高温超导材料(其中Y显+3价,Cu显+2、+3价),该材料所含元素中,电负性最大的元素是______(填元素符号),若YBa2Cu3O7-x材料在T ℃下有超导性,当x=0.2时,n(Cu3+)∶n(Cu2+)=_____。
(3)下表是几种镧系元素的电离能(单位:kJ·mol-1)
第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | |
Ce | 527 | 1047 | 1949 | 3547 |
La | 538 | 1067 | 1850 | 4819 |
Lu | 532 | 1340 | 2022 | 4370 |
Yb | 604 | 1174 | 2417 | 4203 |
据此,判断形成+3价化合物最稳定的元素是____(填元素符号)。
(4)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为____,1 mol CH2=CH2中含有的σ键数目为_______;常温下l,2-二碘乙烷为液体而乙烷为气体,其主要原因是_____。
(5)从磷钇矿中可提取稀土元素钇(Y),某磷钇矿的结构如图。
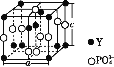
该磷钇矿的化学式为____,与PO43-互为等电子体的阴离子有____(写出两种离子的化学式)。已知晶胞参数a=0.69 nm,c=0.60 nm,阿伏加德罗常数为NA,则晶胞的密度为____g·cm-3(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】合理处理燃气中的H2S,不仅可资源化利用H2S,还可减少对大气的污染。回答下列问题:
(1)反应2H2S(g)=2H2(g)+S2(g) ΔH=+171.59 kJ·mol-1,该反应可在____(填“低温”“高温”或“任何温度”)下自发进行。
(2)利用H2S代替H2O通过热化学循环可高效制取H2,原理如图a所示:
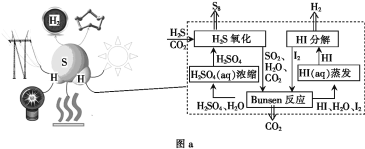
①“Bunsen反应”的离子方程式为________。
②已知键能E(I—I)=152.7 kJ·mol-1,E(H—H)=436.0 kJ·mol-1,E(H—I)=298.7 kJ·mol-1,HI气体分解为碘蒸气和氢气的热化学方程式为________。
③上述循环过程总反应方程式为________。
(3)Ahmed Daham Wiheeb等介绍的一种燃料电池的装置如图b所示:
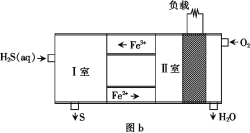
通入O2的电极为________(填“正极”或“负极”),每消耗3.36 L(标准状况下)O2,理论上消耗H2S的质量为____。
(4)为探究H2S直接热解[H2S(g) ![]() H2(g)+
H2(g)+![]() S2(g)],在一密闭容器中充入1 mol H2S与4 mol N2(N2不参与反应),维持总压在101 kPa下进行实验,图c是不同温度下反应时间与H2S的转化率的关系,图d是平衡时气体组成与温度的关系。
S2(g)],在一密闭容器中充入1 mol H2S与4 mol N2(N2不参与反应),维持总压在101 kPa下进行实验,图c是不同温度下反应时间与H2S的转化率的关系,图d是平衡时气体组成与温度的关系。
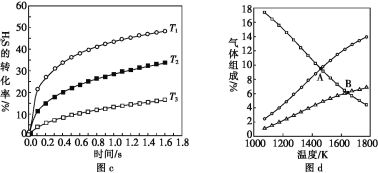
①图c中温度由高到低的顺序是________。
②图d中A点H2S的平衡转化率为______,B点时反应的平衡常数Kp=____(已知![]() ≈10)。
≈10)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Co(CH3COO)2·4H2O(乙酸钴)是一种重要的有机化工原料。回答下列问题:
(1)以工业品氧化钴(CoO)为原料制备乙酸钴。(已知CoO与CH3COOH溶液反应缓慢,Co2+能与H+、NO3-大量共存)可能用到的试剂:Na2CO3溶液、CH3COOH溶液、HNO3溶液。先将CoO溶于____(填化学式,下同)溶液制得____溶液;在不断搅拌下,向制得的溶液中不断加入____溶液至不再产生沉淀,静置,过滤,洗涤;向沉淀中加入___溶液至沉淀完全溶解,调节pH约为6.8,经一系列操作得Co(CH3COO)2·4H2O。
(2)为探究乙酸钴的热分解产物,先在低于100 ℃时使其脱去结晶水,然后用下列装置进行实验(已知CO能与PdCl2溶液反应生成黑色Pd沉淀):
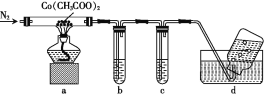
①通N2的目的是______。
②澄清石灰水和PdCl2溶液分别用于检验CO2和CO,其中盛放PdCl2溶液的装置是____(填字母)。
③实验结束时,为防止倒吸,正确的操作是______。
④装置a中完全反应后得到钴的一种氧化物,固体残留率(![]() ×100%)为45.4%。该氧化物为____。
×100%)为45.4%。该氧化物为____。
⑤装置a在加热过程中没有水生成,最终生成的固体氧化物质量为3.0125 g,装置b和c中的试剂均足量(b、c中得到固体的质量分别为2.5 g、10.6 g),集气瓶中收集到的气体为C2H6和N2,则装置a中发生反应的化学方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4mol
C.参加反应的HCl的质量为146g
D.被还原的MnO2的物质的量为1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生下列反应:2HI![]() H2+I2。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为 ( )
H2+I2。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为 ( )
A. 5 sB. 10 sC. 大于10 sD. 小于10 s
查看答案和解析>>
科目: 来源: 题型:
【题目】NiSO4是化学镀镍的原料,一种用废雷尼镍催化剂(已预处理,主要含NiO,还含有少量Fe、Cr及不溶物)制备NiSO4·7H2O的工艺流程如下:

回答下列问题:
(1)化学镀镍总反应为6NaOH+2NiSO4+NaH2PO2=2Ni+Na3PO4+2Na2SO4+4H2O,每生成1 mol Ni,转移电子的物质的量为____。
(2)“溶解”时,在反应器中加入湿料及水,为节约能耗,且维持反应始终在一定温度下进行,应进行的操作是________。
(3)“氧化”时,Fe2+被氧化的离子方程式为________。
(4)“滤渣2”的成分是______。
已知在实验条件下,几种离子开始沉淀和沉淀完全的pH如下表所示:
Ni2+ | Fe2+ | Cr3+ | Fe3+ | |
开始沉淀pH | 6.2 | 7.6 | 4.5 | 2.3 |
沉淀完全pH | 8.6 | 9.1 | 5.6 | 3.3 |
(5)“浓缩”时,加入H2SO4调节pH为3.5~4.0的目的是____;由浓缩液得到产品的步骤为____。
(6)测定产品镍的质量分数[w(Ni)]的实验步骤如下:准确称取0.1000 g产品于250 mL锥形瓶内,加入25 mL水、0.5 g氟化钠、10 mL氨性缓冲溶液、约0.1 g紫脲酸铵指示剂,摇匀,用0.0250 mol·L-1 EDTA滴定至试液呈紫红色为终点(Ni2++H2Y2-=NiY2-+2H+),消耗EDTA溶液14.00 mL,则产品中w(Ni)=____%。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知金属钠的活泼性非常强,甚至在常温时能和水发生反应2Na+2H2O===2NaOH+H2↑。现将9.2克钠、7.2克镁、8.1克铝分别放入100克10.95%的盐酸中,同温同压下产生气体的质量比是( )
A. 1∶2∶3B. 4∶3∶3C. 8∶6∶9D. 1∶1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com