
科目: 来源: 题型:
【题目】一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能。下列说法中不正确的是
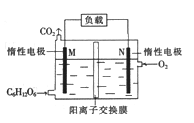
A. M极作负极,发生氧化反应
B. 电子流向:M→负载→N→电解质溶液→M
C. N极的电极反应:O2+4H++4e-=2H2O
D. 当N极消耗5.6L(标况下)气体时,最多有NA个H+通过阳离子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20 g·mL-1。
(1)此浓盐酸中HCl的物质的量浓度是________。
(2)配制100 mL该浓盐酸,需要标准状况下HCl的体积为________。
(3)配制100 mL 3.00 mol·L-1的盐酸,需以上浓盐酸的体积为________。
(4)将10.0 mL 3.00 mol·L-1的盐酸与10.0 mL 1.00 mol·L-1的MgCl2溶液混合,则混合溶液中Cl-的物质的量浓度是________。(设混合后溶液的体积不变)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有21.6 g由CO和CO2组成的混合气体,在标准状况下其体积为13.44 L。回答下列问题:
(1)该混合气体的平均摩尔质量为________。
(2)混合气体中碳原子的质量为________。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
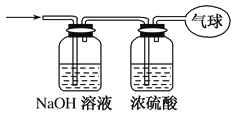
①气球中收集到的气体的摩尔质量为________。
②气球中收集到的气体中,电子总数为________(用NA表示阿伏加德罗常数的值)。
③气球的体积为________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D为四种可溶性盐,它们的阳离子分别是Ba2+、Ag+、Na+、Cu2+中的一种,阴离子分别是NO![]() 、SO
、SO![]() 、Cl-、CO
、Cl-、CO![]() 中的一种(离子在物质中不能重复出现)。现做如下实验:
中的一种(离子在物质中不能重复出现)。现做如下实验:
①把四种盐分别溶于盛有蒸馏水的四支试管中,只有C的溶液呈蓝色;
②向①的四支试管中分别加入盐酸,B的溶液中有沉淀生成,D的溶液中有无色无味的气体逸出。
根据①②实验现象回答下列问题。
(1)写出A、C的化学式:A________________,C_______________。
(2)写出盐酸与D反应的离子方程式:_________________________。
(3)写出C与Ba(OH)2溶液反应的离子方程式:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学欲通过实验验证氯元素的非金属性强于硫元素。请帮他们完成实验报告。
(1)他们将过量硫粉与少量铁粉混合后隔绝空气加热,制得并分离出固体产物A,请填空。
实验步骤和操作 | 实验现象 | 实验结论或解释 |
①取少量A于试管中,加入足量稀硫酸 | 固体完全溶解,产生有臭鸡蛋气味的气体B | 硫粉与铁粉混合后隔绝空气加热,制得固体产物A是______(填化学式) |
②将B通入足量水中 | 得到无色溶液C | |
③向①的试管中加入KSCN溶液 | 溶液无明显变化 | |
④将浓盐酸滴到KMnO4固体上 | 产生黄绿色气体 | 反应生成氯气 |
⑤将红热的铁丝(少量)伸入上述黄绿色气体中 | 铁丝剧烈燃烧,产生大量棕黄色的烟 | 反应的化学方程式为_____ |
⑥将⑤中所得固体产物溶于水,在所得溶液中滴加KSCN溶液 | 观察到________(填现象) |
(2)综合上述实验现象和结论___(填“能”或“不能”)验证氯元素的非金属性强于硫元素,理由是________。
(3)某同学将上述实验中④所得氯气直接通入无色溶液C中,观察到产生淡黄色固体,反应的化学方程式为_____________,此实验______(填“能”或“不能”)验证氯元素的非金属性强于硫元素。
(4)某同学认为将步骤①中的稀硫酸换成稀盐酸,若同样产生有臭鸡蛋气味的气体B,则可以说明氯元素的非金属性强于硫元素,他的观点______(填“正确”或“错误”),原因是:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计制备草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下:
I.FeCl3的制备。
某小组用氯气与金属铁反应制备无水三氯化铁,并设计(Ⅰ)和(Ⅱ)两套不同的收集方案。已知FeCl3呈棕红色、易潮解,100℃左右时升华。
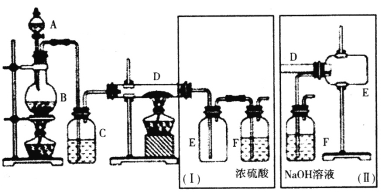
(1)B中反应的离子方程式为___。
(2)(Ⅰ)和(Ⅱ)中装置F的作用分别是___;___。
如果选用(Ⅱ)来完成实验,则必须采取的改进措施是___。
Ⅱ.利用FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]。制备流程如图所示:
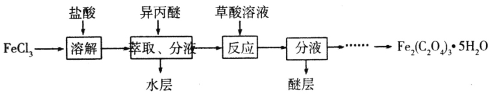
已知:异丙醚是微溶于水的液体,FeCl3在异丙醚中的溶解度比在水中大;草酸铁能溶于水和酸,不溶于醇和醚。
(1)上述流程中FeCl3能被异丙醚萃取,其原因是__;萃取所用的主要实验仪器为___;从反应后溶液中分离并获得Fe2(C2O4)3·5H2O的实验步骤为__。
(2)检验萃取、分液后所得水层中是否含有Fe3+,可选用的试剂为___。
Ⅲ.测定草酸铁晶体Fe2(C2O4)3·5H2O中铁的含量。
(1)称量m g样品于锥形瓶中,加水溶解,用cmol·L-1KMnO4溶液(H2SO4酸化)滴定至终点,其反应离子方程式为___。
(2)向上述溶液中加入过量锌粉,充分反应后过滤、洗涤,将滤液及洗涤液收集到锥形瓶中。
(3)用cmol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为___%。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)按![]() X(X为元素符号)格式写出含有8个质子、10个中子的原子的化学符号:_________。
X(X为元素符号)格式写出含有8个质子、10个中子的原子的化学符号:_________。
(2)根据下列微粒回答问题:![]() H、
H、![]() H、
H、![]() H、14C、14N、16O、35Cl2、37Cl2。
H、14C、14N、16O、35Cl2、37Cl2。
①以上8种微粒共有________ 种核素,共________ 种元素。
②互为同位素的是________ 。
③质量数相等的是________ 和________ ,中子数相等的是________ 和________ 。
(3)相同物质的量的14CO2与S18O2的质量之比为________;电子数之比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出下列化合物的电子式:
①CO2:_______________;②Na2O2:______________;③N2:________________;
(2)有下列物质:①金属铜 ②NaOH ③I2 ④MgCl2 ⑤Na2O2 ⑥氩气
回答下列问题:
①不存在化学键的是:______________________________________。
②只存在非极性键的是:_____________________________________。
③只存在离子键的是:_______________________________________。
④ 既存在离子键又存在极性键的是:___________________________。
⑤ 既存在离子键又存在非极性键的是:___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.FeS2![]() SO2
SO2![]() H2SO4
H2SO4
B.N2![]() NH3
NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3![]() Fe(OH)3
Fe(OH)3
D.MnO2![]() Cl2
Cl2![]() 漂白粉
漂白粉
查看答案和解析>>
科目: 来源: 题型:
【题目】关于氢键,下列说法正确的是
A.分子中有N、O、F原子,分子间就存在氢键
B.因为氢键的缘故,![]() 熔沸点高
熔沸点高
C.NH3的稳定性很强,是因为其分子间能形成氢键
D.“可燃冰” 甲烷水合物(8CH4·46H2O)中CH4与H2O之间存在氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com