
科目: 来源: 题型:
【题目】过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液加入二氧化锰后迅速产生大量气体;实验②、③中红色均不褪去。下列分析错误的是

A. 过氧化钠与水反应产生的气体为O2
B. 过氧化钠与水反应需要MnO2作催化剂
C. 实验②、③证明使酚酞褪色的不是氢氧化钠和氧气
D. 过氧化钠与水反应可能生成了具有漂白性的H2O2
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是中学化学中常用于化合物的分离和提纯装置,请根据装置回答问题:
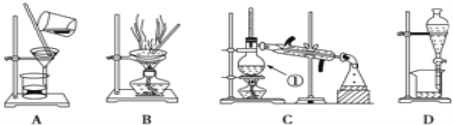
下图是中学化学中常用于化合物的分离和提纯装置,请根据装置回答问题:
(1)装置B中被加热仪器的名称是_____,装置C中①的名称是_________。
(2)某硝酸钠固体中混有少量硫酸钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液。
实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验。
选择试剂 | ① | Na2CO3溶液 | ④ |
实验操作 | ② | ③ | 加热 |
所加入的试剂①可以是_____(填化学式),证明溶液中SO42-已经除尽的操作是__________。加入Na2CO3溶液的目的是__________,所加入的试剂④是____________ (填化学式)。
(3)青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺为:
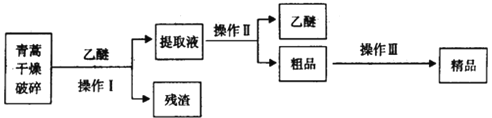
若要在实验室模拟上述工艺,操作I选择的实验操作是_____,操作Ⅱ选择的实验操作是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列正确的叙述有()
A.CO2、NO2均为酸性氧化物,CaO、Na2O2均为碱性氧化物
B.Fe2O3不可与水反应得到Fe(OH)3,但能通过化合反应和复分解反应来制取Fe(OH)3
C.灼热的炭与CO2反应、![]() 与
与![]() 的反应均可设计成原电池
的反应均可设计成原电池
D.电解、电泳、电离、电镀、电化学腐蚀过程均需要通电才能发生
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
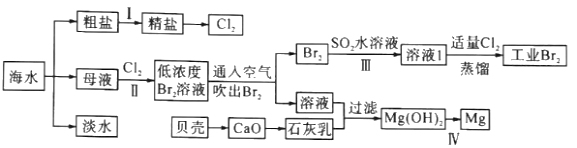
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:__。
(2)海水提溴,制得1molBr2需要消耗__molCl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是___。步骤Ⅱ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为___。
(3)判断Mg(OH)2是否洗涤干净的操作是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化磷(PCl3)是一种基础化工原料使用广泛需求量大。实验室可用白磷与氯气反应制备三氯化磷,实验装置如图所示(夹持装置未画出)。
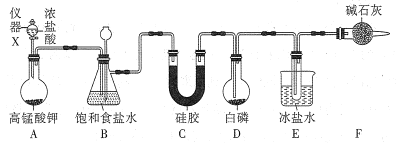
已知:①氯气与白磷反应放出热量(温度高于75℃)。
②PCl3和PCl5遇水强烈反应并产生大量的白雾。
③PCl3和PCl5的物理常数如下:
熔点 | 沸点 | |
PCl3 | -112℃ | 76℃ |
PCl5 | 146℃ | 200℃分解 |
回答下列问题:
(1)仪器X的名称是___;装置A中发生反应的离子方程式为___。
(2)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C或D中是否发生堵塞,若装置C或D中发生堵塞时B中的现象是__。
(3)为防止装置D因局部过热而炸裂,实验开始前应在圆底烧瓶的底部放少量__(填“干沙”或“水”)。
(4)装置E的烧杯中冰盐水的作用是___。
(5)装置F的作用:一是防止空气中水蒸气的进入;二是___。
(6)前期白磷过量生成PCl3,后期氯气过量生成PCl5,从PC13和PCl5的混合物中分离出PCl3的最佳方法是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如图:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJmol-1
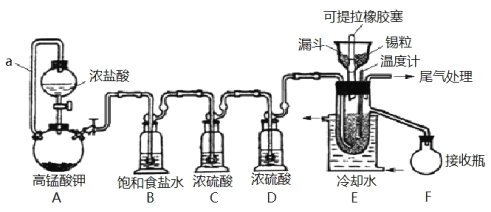
可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,需提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a的作用是___。
(2)A中反应的化学方程式是___。
(3)B的作用是___。
(4)E中冷却水的作用是___。
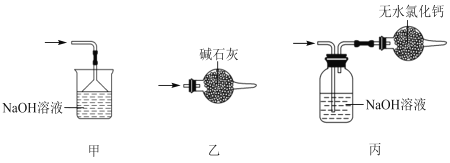
(5)尾气处理时,可选用的装置是___(填序号)。
(6)锡粒中含铜杂质致 E 中产生 CuCl2,但不影响 F 中产品的纯度,原因是___。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有___(填序号)
A.分液漏斗 B.温度计 C.吸滤瓶 D.冷凝管 E.蒸馏烧瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
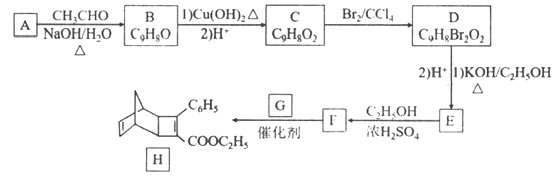
已知:①![]()
②![]()
回答下列问题:
(1)A中官能团的名称为________。由F生成H的反应类型为________。
(2)E生成F化学方程式为______________________。
(3)G为甲苯的同分异构体,G的结构简式为________ (写键线式)。
(4)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式__________。
(5)写出甲苯合成A的合成路线(用流程图表示,无机试剂任选)__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的Cu2S投入到足量浓硝酸中,收集到气体nmol,向反应后的溶液(存在Cu2+和SO42-)中加入足量NaOH,产生蓝色沉淀,过滤、洗涤、灼烧,得到CuO48.0g,若上述气体为NO和NO2混合物,且体积比为1:2。则n为( )
A.3.28B.1.80C.0.80D.1.63
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.KClO3和浓盐酸在一定温度下反应,会生成橙黄色的易爆物二氧化氯(ClO2)气体,该反应的化学方程式为2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)该反应的还原产物是_____________ (填化学式)。
(2)在反应中浓盐酸表现出来的性质是________(填字母)。
A 只有还原性 B 只有氧化性 C 还原性和酸性 D 氧化性和酸性
(3)若该反应产生2.24L(标准状况)ClO2,则转移电子的物质的量为_____________。
(4)某地生产的氧化钠井盐中含有少量的剧毒物质氰化钠(NaCN),用ClO2可除去其中的氰化钠,从而得到纯净的食盐,同时产生两种无毒气体。写出该反应的化学方程式: __________。
Ⅱ.(5)一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为_______mol;
(6)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾为原料制取氧气,当制得同温同压下相同体积的氧气时,三个反应中转移的电子数之比为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]3H2O为绿色晶体,易溶于水,难溶于乙醇、丙酮等有机溶剂。
I.三草酸合铁(Ⅲ)酸钾晶体的制备
①将5g(NH4)2Fe(SO4)2·6H2O晶体溶于20mL水中,加入5滴6 mol·L-1H2SO4酸化,加热溶解,搅拌下加入25mL饱和H2C2O4溶液,加热,静置,待黄色的FeC2O4沉淀完全以后,倾去上层清液,倾析法洗涤沉淀2-3次。
②向沉淀中加入10mL饱和草酸钾溶液,水浴加热至40℃,用滴管缓慢滴加12mL5%H2O2,边加边搅拌并维持在40℃左右,溶液成绿色并有棕色的沉淀生成。
③加热煮沸一段时间后,再分两批共加入8mL饱和H2C2O4溶液(先加5mL,后慢慢滴加3mL)此时棕色沉淀溶解,变为绿色透明溶液。
④向滤液中缓慢加入10mL95%的乙醇,这时如果滤液浑浊可微热使其变清,放置暗处冷却,结晶完全后,抽滤,用少量洗涤剂洗涤晶体两次,抽干,干燥,称量,计算产率。
已知制备过程中涉及的主要反应方程式如下:步骤②6FeC2O4+3H2O2+6K2C2O4=4K3[Fe(C2O4)3]+2Fe(OH)3,步骤③2Fe(OH)3+3H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O,请回答下列各题:
(1)简述倾析法的适用范围______________,步骤③加热煮沸的目的是_______________。
(2)下列物质中最适合作为晶体洗涤剂的是____________________(填编号)。
A.冷水 B.丙酮 C.95%的乙醇 D.无水乙醇
(3)有关抽滤如图,下列说法正确的是_____________。

A.选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B.右图所示的抽滤装置中,只有一处错误,即漏斗颈口斜面没有对着吸滤瓶的支管口
C.抽滤得到的滤液应从吸滤瓶的支管口倒出
D.抽滤完毕后,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关水龙头,以防倒吸
Ⅱ.纯度的测定
称取1.000g产品,配制成250mL溶液,移取25.00mL溶液,酸化后用标定浓度为0.01000 mol·L-1的高锰酸钾溶液滴定至终点,三次平行实验平均消耗高锰酸钾溶液24.00mL。
(4)滴定涉及反应的离子方程式:___________________________________。
(5)计算产品的纯度_____________________(用质量百分数表示)。(K3[Fe(C2O4)3]·3H2O的相对分子质量为491)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com