
科目: 来源: 题型:
【题目】实验室里需用500mL0.1mol/L的硫酸铜溶液,现选取500mL容量瓶进行配制,有关以下操作正确的是()
A.称取8.0g硫酸铜固体,加入500mL水
B.配制好的硫酸铜溶液应转移到细口试剂瓶中,并贴上标签
C.滴加蒸馏水不慎超过刻度线,立即用胶头滴管将多余的液体
D.定容摇匀后,发现配制溶液液面低于刻度线,应用胶头滴管滴加蒸馏水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
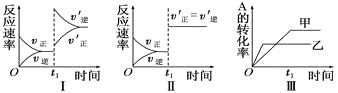
A. 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响
B. 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
D. 图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸二氢钾(KH2PO4)是一种重要的化工产品,工业上常用作缓冲剂和培养剂,农业上常用作 复合肥料。以氟磷灰石[主要成分为Ca5F(PO4)3,还含有少量的Fe2O3、A12O3等杂质]为原料制备KH2PO4 晶体的一种流程如下:
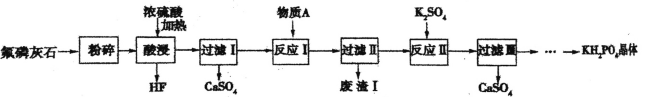
回答下列问题:
(1)“酸浸”过程中生成磷酸的化学方程式为________,若用盐酸代替硫酸,磷酸的产率会明显提高,原因是___,该过程所用的仪器不能釆用二氧化硅陶瓷材料,其主要原因是_____________(用化学方程式表示)。
(2)己知物质A为CaCO3,其作用是调节溶液pH,则“废渣I”的主要成分为__________。
(3) “反应II ”的化学方程式为 _______。
(4)将获得的KH2PO4晶体进行进一步提纯的方法名称为____。
(5)若用1000kg质量分数为50.4%的氟磷灰石来制取磷酸二氢钾晶体,其产率为80%,则生产出的磷酸二氢钾晶体的质量为 _____kg. 已知摩尔质量 M(Ca5F(PO4)3)=504g/mol,M(KH2PO4)=136 g/mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】同温同压下,体积为VL两容器分别充满了CO气体和CO2气体,下列有关说法不正确的是( )
A.两容器含有气体分子数目相同
B.两容器气体密度之比为:7:11
C.两容器中所含氧原子个数之比为:1:2
D.两容器所含气体的物质的量均为:![]() mol
mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温、恒容密闭容器中,进行反应COS(g)+H2(g) H2S(g)+CO(g)。下列说法中能说明反应已达到平衡状态的是:
A. c(COS)保持不变B. c(H2S)=c(H2)
C. 容器中气体密度保持不变D. v(H2)=v(H2S)
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A.含有相同铜原子数的Cu2S和CuO的质量相等B.2g氢气所含质子数目为NA
C.lmol氨气含有的原子数目为2NAD.22.4LCH4所含电子数目为l0NA
查看答案和解析>>
科目: 来源: 题型:
【题目】一氧化二氯(Cl2O)是一种常用的氯化剂。常温下,Cl2O是棕黄色、有刺激性气味的气体,熔 点为-120.6°C,沸点为2.0°C,易与水反应生成次氯酸。实验室欲用氯气通入含水8%的碳酸钠固体中 制备并收集少量纯净的Cl2O,请用下列装置设计实验并探究相关物质的性质。
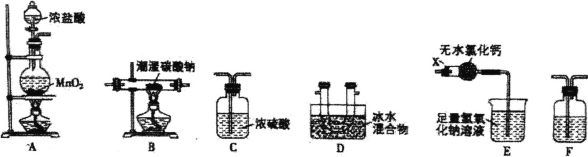
(1)装置E中仪器X的名称为 ______。
(2)装置的连接顺序是A __________(每个装置限用一次)。
(3)装置F中盛装试剂的名称为______,装置E中无水氯化钙的作用是 ________.。
(4)装置B残留固体中除NaCl外还含有一种酸式盐M,写出装置B中发生反应的化学方程式 _______。
(5)证明残留固体中含有M的最简单的实验方案是: _______。
(6)测定残留固体中M的质量分数:取mg样品加适量蒸馏水使之溶解,加入几滴酚酞,用0.1 mol/L 的盐酸标准溶液滴定至溶液由红色变为无色,消耗盐酸V1mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸V2 mL.。
①实验时用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、____。
②求残留固体中M的质量分数__________(用含m、V1和![]() 的代数式表示)。
的代数式表示)。
③若用甲基橙作指示剂滴定结束时,滴定管尖头有气泡,测定结果将____填“偏高"、“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一处于平衡状态的可逆反应:X(s)+3Y(g)![]() 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A.①③⑤B.②③⑤C.②③⑥D.②④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向100mL0.lmol/LNH4Cl溶液中,逐滴滴加0.1mol/LNaOH溶液。NH4+和NH3H2O的变化趋势如图所示(不考虑生成NH3,已知NH3H2O的kb=1.8![]() 10-5),下列说法正确的是( )
10-5),下列说法正确的是( )

A.a=0.005
B.在M点时,n(H+)—n(OH—)=(0.005—a)mol
C.随着NaOH溶液的滴加, 不断增大
不断增大
D.当n((NaOH)) =0.01 mol 时,c ((NH3H2O)![]() c (Na+)
c (Na+)![]() c (OH-)
c (OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为___________________。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
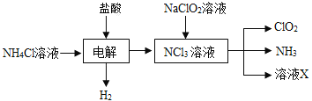
①电解时发生反应的化学方程式为_____________________________________。
②溶液X中大量存在的阴离子有_______________________________________。
③除去ClO2中的NH3可选用的试剂是______(填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
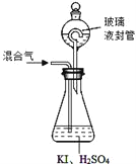
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为_________________________________。
②玻璃液封装置的作用是 ______________。
③V中加入的指示剂通常为__________,滴定至终点的现象是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com