
科目: 来源: 题型:
【题目】现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生:N2+3H2![]() 2NH3。下列有关说法正确的是
2NH3。下列有关说法正确的是
A.达到化学反应最大限度时,正反应和逆反应的速率都为零
B.当符合:3正N2=正H2时,反应达到最大限度
C.达到化学最大限度时,单位时间消耗a mol N2,同时生成3a mol H2
D.当N2、H2、NH3的分子数比为1∶3∶2,反应达到最大限度态
查看答案和解析>>
科目: 来源: 题型:
【题目】3.2g CH3OH(l)完全燃烧生成液态水和CO2,放出72.576 kJ的热量。下列热化学方程式正确的是
A.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH = - 72.576 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH = - 72.576 kJ·mol-1
B.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(g) ΔH = - 72.576 kJ·mol-1
O2(g)===CO2(g)+2H2O(g) ΔH = - 72.576 kJ·mol-1
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH = - 1451.52 kJ·mol-1
D.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH = + 725.76 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH = + 725.76 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】“花卉保鲜剂”是一种可以延长花期的试剂。如表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(gmol1) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.316 | 158 |
硝酸银 | 0.0075 | 170 |
(1)下列“花卉保鲜剂”的成分中,属于非电解质的是______,可做杀菌剂的是____
A. 高锰酸钾B. 硫酸钾C. 蔗糖D. 硝酸银E. 水
(2) 配制1L上述“鲜花保鲜剂”需要高锰酸钾______mol。
(3)在溶液配制过程中,下列操作会使配制结果无影响的是______。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚配制完一定物质的量浓度的氯化钠溶液未洗涤
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为______mol/L。
(5)如果用高铁酸钾(K2FeO4)代替高锰酸钾效果会更好,湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O.碱性条件下,氧化剂与还原剂的物质的量的比为3:2发生反应,写出并配平湿法制备高铁酸钾的离子反应方程式___________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题。该小组设计的简单实验装置如图所示:

该实验的主要操作步骤如下:
①配制100mL1.0molL﹣1的盐酸溶液;
②用_______(填仪器名称并注明规格)量取10.0mL1.0molL﹣1的盐酸溶液加入锥形瓶中;
③称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为______;
④往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
(1)用文字表述实验步骤④中检查装置气密性的方法:______。
(2)实验步骤⑤中应选用______(填序号)的量筒。
A.100mL B.200mL C.500mL
读数时除恢复到室温外,还要注意______。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=______,若未除去镁条表面的氧化膜,则测量结果______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国许多城市为了减少燃煤造成的大气污染,对煤做了多方面的改进:
(1)为了除去煤中的含硫化合物,采用FeCl3脱硫,即用FeCl3溶液浸洗煤粉,发生反应如下:FeS2+14FeCl3+8H2O====2FeSO4+13FeCl2+16HCl(已知FeS2中硫元素的化合价为-1价)。
①该反应的氧化剂是____,若有1 mol FeS2被除去,则发生转移的电子的物质的量是___________。
②为了充分利用Fe2+并减少酸(HCl)污染,本方法中可利用工业废铁屑和Cl2让废液重新生成FeCl3。请写出这一过程中有关的离子方程式:______________;_____________________。
(2)“保护环境,就是保护人类自己”。飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降,它与空气的污染物二氧化硫(SO2)接触时,二氧化硫(SO2)会部分转化为三氧化硫(SO3),其污染更加严重。
①飘尘所起的作用可能是______________.
A. 氧化剂B.还原剂C.催化剂D.载体
发生反应的化学方程式为________________________________________________.(如果是氧化还原反应,请用双线桥标出电子转移的方向和数目)
②冶金工业中常用高压电对气溶胶作用,以除去飘尘,减少对空气的污染,这种做法的依据是___.
A. 布朗运动 B.丁达尔现象 C. 渗析 D. 电泳。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
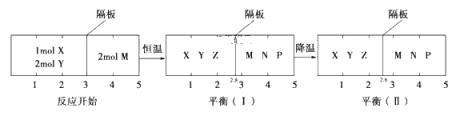
下列判断正确的是( )
A. 反应①的正反应是吸热反应
B. 达平衡(Ⅰ)时,X的转化率为5/6
C. 在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
D. 对于反应②,平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为10:11
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为T 时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,
反应:PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 250 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s内的平均速率v(PCl3)=0.0032mol/(L·s)
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,该反应为放热反应
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前的v正>v逆
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用铂丝按如图进行氨的催化氧化实验,下列说法正确的是( )
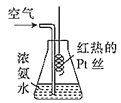
A.通入空气的目的是让氨挥发出来,从而使氧气和氨充分混合
B.瓶口出现少量红棕色气体,说明氨催化氧化的产物是NO2
C.瓶内有白烟出现是由于生成了白色晶体NH4NO3
D.铂丝保持红热说明该反应的ΔH>0
查看答案和解析>>
科目: 来源: 题型:
【题目】印刷线路板废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl-),可用来制备碱式碳酸铜,过程如图:
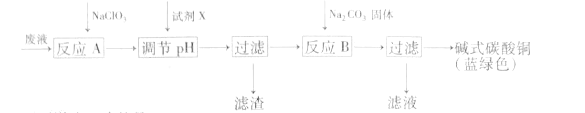
下列说法正确的是( )
A.反应A的离子方程式为:10Fe2++2ClO3-+12H+=10Fe3++Cl2↑+6H2O
B.铜在空气中被腐蚀得到铜锈,其主要成分是碱式碳酸铜
C.NaClO3和Na2CO3中心原子杂化类型均为sp3杂化
D.试剂X可为CuO,主要作用是通过调节pH值把Fe2+转化为Fe(OH)3过滤除去
查看答案和解析>>
科目: 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以左右自由滑动的隔板(其质量忽略不计).其中能表示相同温度时,等质量的氢气与氦气的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com