
科目: 来源: 题型:
【题目】向下列溶液中加入足量Na2O2后,仍能共存的离子是
A.K+、AlO2-、SO42-、Cl-B.Na+、Cl-、CO32-、SO32-
C.Ca2+、Mg2+、HCO3-、NO3-D.NH4+、Ba2+、Cl-、NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】农业上有一句俗语“雷雨发庄稼”,该过程中不会涉及到的化学反应是
A.N2+O2 ![]() 2NOB.2NO+O2 → 2NO2
2NOB.2NO+O2 → 2NO2
C.4NH3+5O2![]() 4NO + 6H2OD.3NO2+H2O → 2HNO3+NO
4NO + 6H2OD.3NO2+H2O → 2HNO3+NO
查看答案和解析>>
科目: 来源: 题型:
【题目】A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示。
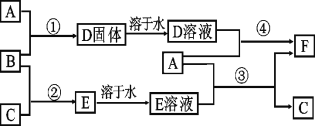
请回答:
(1)写出B物质的化学式:_______;F的化学名称:_______。
(2)写出第②步C在B中燃烧的反应现象:_______。
(3)写出第④步反应的化学反应方程式_______。
(4)F溶液中滴入NaOH溶液可能产生的实验现象是____,写出该反应的化学方程式_____________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列液体均处于25℃,有关叙述正确的是
A. 某物质的溶液pH<7,则该物质属于酸或强酸弱碱盐
B. pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C. pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-)
D. AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
查看答案和解析>>
科目: 来源: 题型:
【题目】关于0.1 mol/L醋酸钠溶液,下列说法正确的是
A. 加少量水稀释时,![]() 增大
增大
B. 向其中再加入少量醋酸钠晶体时,溶液中所有离子浓度都增大
C. 离子浓度大小比较:c(CH3COO-) >c(Na+) >c(OH-) > c(H+)
D. 向其中加入盐酸至恰好呈中性时,c(Na+) = c(CH3COO-)
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定苏打中Na2CO3的含量(含NaHCO3杂质),实验小组设计了如下三个实验方案。
方案Ⅰ.①称量:仪器X的质量为ag;②称量:仪器X和装有试样的质量为bg;③加热;④冷却;⑤称量:仪器X和残余物的质量为cg;⑥重复____________操作,直至恒重,质量为dg。
(1)仪器X是____________(填名称),方案 Ⅰ 的实验原理是:____________(用化学方程式表示)。
(2)请将步骤⑥补充完整:重复____________操作,步骤⑥的目的是:____________。
(3)计算Na2CO3的质量分数要用到的数据是____________(选填a、b、c、d)。
方案Ⅱ.称量一定量样品,选用合适的装置测定样品与硫酸反应生成的气体体积。
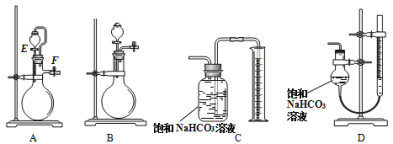
(4)为提高测定准确性,应选用发生装置____________(选填“A”或“B”)和量气装置D;装置D比装置C准确性高的原因是____________(任一条原因)。
(5)检查装置A的气密性:向A的分液漏斗中加入适量水,按图连接好装置,关闭止水夹F,打开活塞E,发现分液漏斗中的水持续滴下,说明A漏气。该判断是否正确,并说明理由:____________。
方案Ⅲ.称量0.2570g样品,置于锥形瓶中,加适量水溶解,滴2滴酚酞试液,用0.1000mol/L盐酸滴定至溶液由浅红色变成无色且半分钟不变色,反应原理:Na2CO3+HCl→NaHCO3+NaCl,重复上述操作两次。
(6)用密度为1.19g/mL、质量分数为0.37的浓盐酸,配制1L0.1000mol/L稀盐酸,所需的定量仪器是:滴定管、1L容量瓶,其中滴定管的作用是____________。滴定管和容量瓶在使用前都要进行的操作是__________。(选填序号)
Y.检漏 Z.用蒸馏水洗涤 W.用待装液润洗
(7)根据表中数据,碳酸钠的质量分数为____________(小数点后保留四位)。
滴定次数 | 样品的质量/g | 稀盐酸的体积/mL | |
滴定前读数 | 滴定后读数 | ||
1 | 0.2570 | 1.00 | 21.01 |
2 | 0.2570 | 0.50 | 20.49 |
3 | 0.2570 | 1.20 | 21.20 |
查看答案和解析>>
科目: 来源: 题型:
【题目】I.N和Li、Na形成的Li3N、NaN3等化合物具有重要的用途。完成下列填空:
(1)氮原子核外能量最高的电子所处的轨道是:____________。锂离子核外电子的轨道表示式是:____________。
(2)已知Li3N熔点为845℃,NH3熔点﹣77.7℃,用物质结构的知识说明这两种含氮化合物熔点差异的可能原因____________。
II.研究者发明了利用锂循环合成氨的工艺,其流程如下:
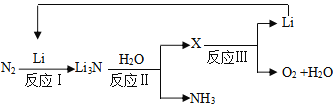
(3)每合成1mol氨,转移电子____________mol;该过程最终得到的氧化产物是____________。
(4)写出反应Ⅱ的化学反应方程式:____________。向0.35gLi3N中加入40mL1mol/L的盐酸,所得溶液中离子浓度由大到小的顺序是:____________。
(5)由元素周期律能得到____________(填序号)。
A.碱性:LiOH<NaOH B.与水反应的剧烈程度:Li<Na
C.溶解度:LiOH<NaOH D.密度:Li<Na
(6)NaN3可用于汽车安全气囊,冲撞时发生如下反应:□NaN3+□KNO3→□K2O+□Na2O+□N2↑,配平此反应的化学方程式,并标出电子转移的数目和方向。____________
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常用的几种气体发生装置如图A、B、C所示:
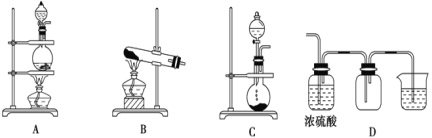
(1)实验室用熟石灰和氯化铵固体制取氨气,应选择____装置,检验该装置气密性的操作方法是_________________。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是____(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的____。
① CO2 ② H2 ③ Cl2
Ⅰ.写出A装置中反应的离子方程式___________________________。
Ⅱ.D装置中小烧杯中应盛放____,目的是_________________。
Ⅲ.若要收集干燥纯净的X气体,上述装置应如何改进:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com