
科目: 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识进行填空(设 NA 表示阿伏加德罗常 数的值)。
(1)标准状况下,0.2 mol 氨气的体积是_______________,含氢原子数是_______________。
(2)H2SO4 的摩尔质量是_______________, 49 g 的 H2SO4 中含有_______________mol 氧原子,能与_______________mol NaOH 恰好完 全反应。
(3)将 0.5 mol Na2CO3溶解在水中,配成 500mL 溶液,所得溶液中溶质的物质的量浓度是 ______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_______________(用离子方程式表示)。已知AlF![]() 在溶液中可稳定存在。
在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
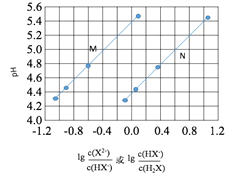
A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】配制240mL 1.00mol/L的H2SO4标准溶液的相关操作:①计算;②量取;③稀释、冷却;④转移、洗涤;⑤定容;⑥摇匀。
(1)现用98%的浓硫酸(密度约为1.8g/cm3)来配制,需用量筒量取浓硫酸的体积为_______________。
(2)实验中所用到的玻璃仪器有烧杯、玻璃棒、量筒、_______________、_______________。
(3)下列操作中会引起所配稀硫酸浓度偏大的操作有_______________。(填字母)
A.用量筒量取浓硫酸时,俯视读数
B.从量筒中倒出量取的浓硫酸后洗涤量筒内壁并把洗涤液转入容量瓶中
C.稀释浓硫酸时有少量液体溅出
D.浓硫酸稀释后未冷却就立即转移到容量瓶中 E.容量瓶中残留少量水即用来配溶液
F.定容摇匀后,发现液面低于刻度线
(4)简述上述配溶液时步骤⑤定容时的操作_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. MgSO4溶液与Ba(OH)2溶液混合:Ba2++![]()
![]() BaSO4↓
BaSO4↓
B. 向NaAlO2溶液中滴入NaHCO3溶液产生白色沉淀:![]() +
+![]() +H2O
+H2O![]() Al(OH)3↓+
Al(OH)3↓+![]()
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2
2![]() +3Cl+4H++H2O
+3Cl+4H++H2O
D. 用稀硝酸洗涤试管内壁的银镜:Ag+4H++![]()
![]() Ag++NO↑+2H2O
Ag++NO↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:第一,有氧气生成;第二,_____________________________。 过氧化钠跟水反应的化学方程式为_______________。
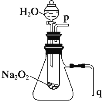
(2)某研究性学习小组拟用如图所示装置进行实验,以证明上述结论。用以验证第一条结论的实验方法和现象是_______________。用以验证第二条结论的实验方法及现象是______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液。请回答下列问题。
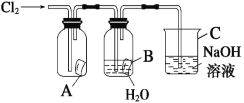
(1)通Cl2一段时间后,A中观察到的现象是_______________,B中观察到的现象是_______________,写出有关反应的化学方程式:_____________________________。
(2)C装置的作用是_____________________________,理由是_______________,写出有关反应的化学方程式:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为 。
(2)已知:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示 ),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN![]() N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
(4)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2 2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将___________能转化为__________能。其电极反应式分别为:负极_________________,正极____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com