
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4 L苯含有的分子数约为NA
B.密闭容器中23 g NO2与N2O4的混合气体中氮原子数为0.5NA
C.1 L 0.1 mol·L-1的NaHCO3溶液中,HCO3- 和CO32- 离子数之和为0.1NA
D.密闭容器中1 mol N2(g)与3 mol H2 (g)反应制备氨气,形成6NA个N-H键
查看答案和解析>>
科目: 来源: 题型:
【题目】中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将①50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:

(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是_________________________________。
(2) 若将盐酸换成同浓度和同体积的醋酸,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”)
(3) 实验中改用40 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上
述实验相比,所放出的热量_________(填“比①大”、 “比①小”或“相等”),理由是_____________________________________________;所求中和热的数值会________(填“相等”或“不相等”),理由是_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按下图装置进行实验,并回答下列问题:
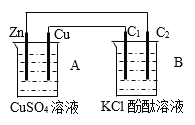
(1)判断装置的名称:A池为__________________;B池为________________;
(2)锌极为___________极,电极反应式__________;
(3)石墨棒C1为________极,电极反应式为_____;石墨棒C2附近发生的实验现象为_____;
查看答案和解析>>
科目: 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的常用试剂是___,证明Fe3+存在的现象是____,配制含Fe2+的溶液时,常常向溶液中加入少量___,使被氧气氧化形成的Fe3+还原为Fe2+。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:___。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
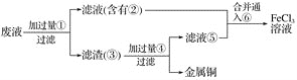
A.请写出上述实验中加入或生成的有关物质的化学式。
①___,②___,③___,④____,⑤____,⑥_____。
B.请写出相关反应的化学方程式。_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的1/10。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式。
正极:____________;负极:________。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,其中焊接在铁闸门的固体材料R可以采用___。
A、铜 B、钠 C、锌 D、石墨
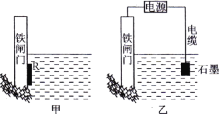
(3)上图中乙方案也可降低铁闸门腐蚀速率,其中铁闸门应该连接在直流电源的________极。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为Zn-Cu原电池的示意图,请回答:
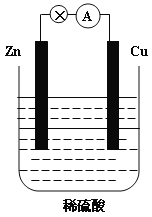
(1)锌片为原电池的______________(填“正”或“负”)极,该极的电极反应式是___________。该反应属于_______________(填“氧化”或“还原”)反应。
(2)__________(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中H+的从_________(填“锌片”或“铜片”)获得电子。
(3)原电池工作一段时间后,H2SO4溶液的浓度_________(填“增大”或“减小”,下同),烧杯中溶液的质量__________。
(4)若锌片质量减轻6.5g,则另一极放出气体的体积为_________L(标准状况)。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国尿素合成塔(尿塔)使用寿命仅为欧美国家的1/4。为此北京钢铁研究院对某尿塔腐蚀过程进行研究,得出下列腐蚀机理:
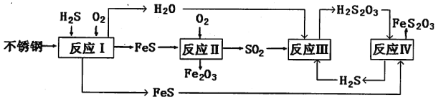
(1)H2S来自合成尿素的天然气。在380K、体积为2L的密闭容器中,存在反应:H2(g)+S(s)![]() H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
①380K时该反应的化学平衡常数为__________。
②下列对该反应分析正确的是_________(填序号)。
(2)反应II的化学方程式为:____________________________________。
(3)已知室温下H2S2O3:K1=2.2×10-1,K2=2.5×10-2。
①Na2S2O3水溶液中电荷守恒式为___________________________;
②反应IV的化学方程式_____________________________________。该反应_________(填“能”或“不能”)说明FeS溶解性强于FeS2O3。
(4)此尿塔的最终腐蚀产物为__________________。为了有效防腐,北钢建议该尿塔在生产中用CuSO4溶液“脱硫(H2S)”,离子反应方程式为_________。(室温下,H2S:K1=1.3×10-7、K2=7.1×10-15。CuS:Ksp=6.3×10-36)
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积/mL | 浓度(mol/L) | 体积/mL | ||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4)∶n(KMnO4) ______________。
(2)探究温度对化学反应速率影响的实验编号是_______ (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 ________.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)1molC2H5OH(1) 完全燃烧生成CO2(g)与H2O(1),放出热量1366.8kJ(写出反应的热方程式)____________
(2)已知H—H键能为436 kJ/mol,H—N键能为391kJ/mol,根据化学方程式:N2 + 3H2 = 2NH3 ΔH=—92.4 kJ/mol,则N≡N键的键能_____
(3)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+216.4kJ/mol
CO(g)+3H2(g) △H=+216.4kJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=______。
CO2(g)+4H2(g) △H=______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A为常见的金属单质,根据如图所示的关系:
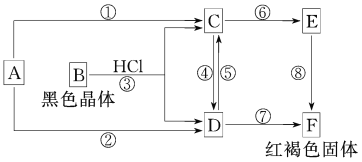
(1)确定A、B、C、D、E、F的化学式:A____________,B____________,C____________,D____________,E____________,F____________。
(2)写出⑧的化学方程式________,④、⑤的离子方程式________,_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com