
科目: 来源: 题型:
【题目】下列有关化学平衡常数的描述中正确的是( )
A. 化学平衡常数的大小取决于化学反应本身,与其他外界条件无关
B. 相同温度下,反应A+BC与反应CA+B的化学平衡常数相同
C. 反应2SO2(g)+O2(g)2SO3(g) ΔH<0的化学平衡常数随温度升高而增大
D. 反应A(g)+B(g)2C(g)的平衡常数表达式为K=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】废定影液含Ag(S2O3)23-和Br-等,实验室从中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取Cl2并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如图所示,下列叙述正确的是( )
A.用装置甲分离Ag2S时,用玻璃棒不断搅拌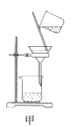
B.用装置乙在通风橱中高温灼烧Ag2S制取Ag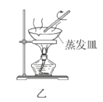
C.用装置丙制备Cl2 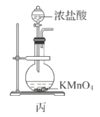
D.用装置丁分液时,先放出水层再换个烧杯继续放出有机层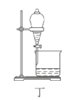
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年3月,我国科学家研发出一种新型的锌碘单液流电池,其原理如图所示。下列说法不正确的是

A. 放电时B电极反应式为:I2+2e-=2I-
B. 放电时电解质储罐中离子总浓度增大
C. M为阳离子交换膜,N为阴离子交换膜
D. 充电时,A极增重65g时,C区增加离子数为4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】以SO2为原料,通过下列工艺可制备化工原料H2SO4和清洁能源H2。下列说法中不正确的是

A. 该生产工艺中Br2被循环利用
B. 在电解过程中,电解槽阴极附近溶液的pH变大
C. 原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+
D. 该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
A.Fe与Cl2反应
B.CO2通入石灰水
C.HNO3中加入Cu
D.AlCl3溶液中滴入NaOH溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是( )

A.M、N的氧化物都能与Z、R的最高价氧化物对应水化物反应
B.Y的单质能从含R简单离子的水溶液中置换出R单质
C.某物质焰色反应呈黄色,该物质一定是含Z元素的盐
D.X、M两种元素组成的化合物熔点很高
查看答案和解析>>
科目: 来源: 题型:
【题目】锂空气电池放电时的工作原理如图所示。下列叙述正确的是( )

A. 放电时Li+由B极向A极移动
B. 电池放电反应为4Li+O2+2H2O===4LiOH
C. B电极反应式为O2+4H++4e-===2H2O
D. 电解液a可以为氯化锂溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1L0.1mol/L的Na2CO3溶液中含阴离子总数为0.1NA
B.7.8gNa2O2与过量CO2反应时,转移的电子数为0.2NA
C.2gH218O与D216O的混合物中所含的中子数和电子数均为NA
D.足量乙烷与22.4L(标准状况)Cl2发生取代反应,形成C-Cl键的数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】对二乙烯苯(如图)可用作树脂、油漆及特种橡胶的原料。下列说法正确的是
![]()
A.分子中所有原子可能共平面B.易溶于甲苯,沸点比甲苯低
C.不能使稀酸性高锰酸钾溶液褪色D.1 mol该物质至多可与2 mol H2加成
查看答案和解析>>
科目: 来源: 题型:
【题目】利用硫酸渣(主要成分为Fe2O3和少量的SiO2、FeO)可以制备高纯度的氧化铁,制备流程如图:
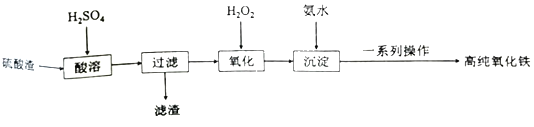
(1)滤渣的主要成分是___。
(2)“氧化”时发生反应的离子方程式为___。
(3)检验沉淀是否完全的方法为___。
(4)一系列操作包括:过滤、沉涤、干燥、___。
(5)用高温分解FeSO4也可以制备较纯的Fe2O3,写出反应的化学方程式___。
(6)上述硫酸渣含铁28%,现需高纯氧化铁64吨,理论上需用硫酸渣多少吨?___(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com