
科目: 来源: 题型:
【题目】下列有关物质的转化关系如图所示(部分反应条件己路去)。A是紫红色的金属单质,B为强酸,E在常温下为无色液体,D、F、G为气体。请回答下列问题:
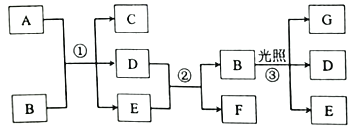
(1)G的化学式为___,实验室中试剂B应保存在___中。
(2)写出反应①的化学方程式:___,反应中B体现的性质为___。
(3)写出反应②的离了方程式:___,实验室中F可用___法收集。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物 H(结构简式为 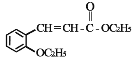 )是合成高分子化合物 M 的单体,H可以通过有机物A(分子式为 C7H8O)和丙酮为原料来进行合成,其合成路线如下:
)是合成高分子化合物 M 的单体,H可以通过有机物A(分子式为 C7H8O)和丙酮为原料来进行合成,其合成路线如下:
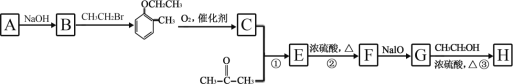
已知:① ![]()
②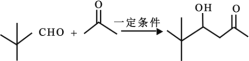
请回答下列问题:
(1)A结构简式为_____,C 中所含官能团的名称是_____;①和③的反应类型分别是_____。
(2)简述溴乙烷中溴原子检验方法_____。
(3)高分子化合物M 的结构简式为_____。
(4)反应③的化学反应方程式为_____。
(5)有机物 C 有多种同分异构体,其中苯环上只有两个侧链的芳香酯的同分异构体有_____种。
(6)设计由苯甲醛和 2-丙醇制备![]() 的合成路线_____(无机试剂任选)。
的合成路线_____(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) ![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等 D. 单位时间内生成1 mol Y的同时生成2 mol X
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl) 为白色粉末,其露置于空气中易被氧化为绿色的碱式氯化铜Cu2(OH)3Cl]。某兴趣小组高温加热分解氯化铜晶体(CuCl2·xH 2O)制备CuCl,其装置如下(加热仪器、夹持仪器省略)
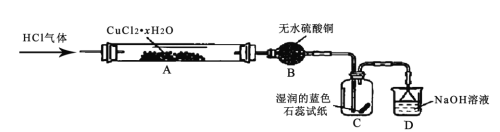
回答下列问题:
(1)装有无水硫酸铜的仪器名称为______,装置 D 的作用是______。
(2)通入 HCl 气体的主要作用是______。
(3)实验过程中,装置C 中的现象为______。
(4)硬质玻璃管A 中发生主要反应的化学方程式为__________。
(5)为测定 CuCl2·xH 2O 中结晶水的数目 x,实验步骤如下:
a 用电子天平称取一定质量的氯化铜晶体;
b 在坩埚中充分灼烧;
c 在干燥器中冷却;
d 称量所得黑色固体质量;
e 重复 b~d 操作直至连续两次称量差值不超过 0.001g。
①若氯化铜晶体质量为 3.384g,最终得到黑色固体质量为 1.600g,则 x=______(精确到 0.1)。
②若加热时有固体溅出坩埚,则测得x 值______填“偏大”“不变”或“偏小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】由 H、B、C、N、O、F 等元素通过共价键形成的物质在工业生产中有广泛的应用。回答下列问题:
(1)氧原子核外有_____种不同运动状态的电子,有_______ 种不同能量的原子轨道。
(2)Bi 是 N 的同主族元素,与 N 原子相差 4 个电子层,基态 Bi 原子的价电子轨道排布图为______。
(3)C2H4 与N2H4 在水中的溶解度相差很大, 出现这种现象的主要原因是 __________。
(4)H2C2O4 分子中碳原子的杂化类型是 _________,写出一种与 C2O42-互为等电子体的分子的化学式_______________。
(5)NaHF2 可用于制无水氟化氢和雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160℃分解,NaHF2 中所含作用力的类型有___________(填字母)。
a 离子键 b 共价键 c 配位键 d 氢键
(6)六方氮化硼晶体结构如图 I 所示,氮化硼的化学式为______在其晶胞(图Ⅱ所示)中层内 BN 核间距为 apm,层间 BN 核间距为bpm,其密度为______g·cm -3(阿伏加德罗常数的值为 NA,用含 a、b、NA 的代数式表示)

查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于电化学的叙述正确的是( )
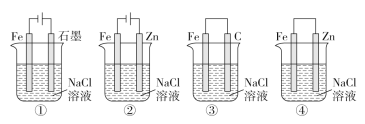
A. 图①两极均有气泡产生,滴加酚酞溶液时石墨一极变红
B. 图②装置中Fe电极参与反应发生腐蚀
C. 图③可以模拟钢铁的吸氧腐蚀,碳棒一极的电极反应式:O2+2H2O+4e-=4OH-
D. 上述4个装置中,图①、②中Fe腐蚀速率较快,图③中Fe腐蚀速率较慢
查看答案和解析>>
科目: 来源: 题型:
【题目】在1200 ℃时,天然气脱硫工艺中会发生下列反应:H2S(g)+![]() O2(g)===SO2(g)+H2O(g) ΔH1,2H2S(g)+SO2(g)===
O2(g)===SO2(g)+H2O(g) ΔH1,2H2S(g)+SO2(g)===![]() S2(g)+2H2O(g) ΔH2,H2S(g)+1/2O2(g)===S(g)+H2O(g) ΔH3,2S(g)===S2(g) ΔH4 则ΔH4的正确表达式为( )
S2(g)+2H2O(g) ΔH2,H2S(g)+1/2O2(g)===S(g)+H2O(g) ΔH3,2S(g)===S2(g) ΔH4 则ΔH4的正确表达式为( )
A. ΔH4=![]() (ΔH1+ΔH2-3ΔH3)B. ΔH4=
(ΔH1+ΔH2-3ΔH3)B. ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C. ΔH4=![]() (ΔH1+ΔH2-3ΔH3)D. ΔH4=
(ΔH1+ΔH2-3ΔH3)D. ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目: 来源: 题型:
【题目】下图用来研究钢铁制品的腐蚀,装置的气密性良好,且开始时U形管两端的红墨水液面相平。一段时间后能观察到铁钉生锈。下列说法不正确的是( )
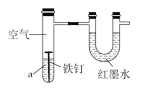
A. 铁钉表面发生的反应为Fe-3e-=Fe3+
B. 若液体a为稀醋酸,则U形管液面右高左低
C. 若液体a为食盐水,则U形管液面左高右低
D. 若液体a为食用油,则铁钉生锈速率较慢
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
A. v(N2)=0.25 mol·L-1·min-1
B. v(H2)=0.75 mol·L-1·min-1
C. v(NH3)=1 mol·L-1·min-1
D. v(NH3)=0.5 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在工业废气和汽车尾气中含有多种氮氧化物,氮氧化物能破坏臭氧层,产生光化学烟雾,是造成大气污染的来源之一。
(1)处理 NO 尾气通常是将 NO 与 O2 混合通入碱液中吸收。已知一定条件下有下列反应:
Ⅰ:2N2O5(g) ![]() 4NO2(g)+O2(g) △H1
4NO2(g)+O2(g) △H1
Ⅱ:2NO2(g)![]() 2NO(g)+O2(g) △H2
2NO(g)+O2(g) △H2
Ⅲ:2NaOH(aq)+N2O5(g)=2NaNO3(aq)+H2O(1) △H3
写出 NO 和O2 的混合物溶于NaOH 溶液生成硝酸盐的热化学方程式______。
(2)常温下,NO 极易被 O2 氧化为 NO2,温度高于 423K 时,NO2 发生分解:2NO2(g) ![]() 2NO(g)+O2(g)△H=114kJ·mol -1,实验测得:
2NO(g)+O2(g)△H=114kJ·mol -1,实验测得:
υ正=υ(NO2)消耗=k 正C2(NO2), υ逆=υ(NO)消耗=2υ(O2) 消耗=k 逆c2(NO)·c( O2),k 正、k 逆 为速率常数,受温度影响。不同温度下,将 NO2 置于体积为 VL 的密闭容器中,NO2 的物质的量的浓度与反应时间的关系如图所示:
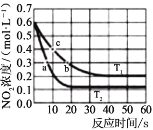
①T1 温度下 0-10s 内,O2 的反应速率υ(O2)=______、平衡常数 KT1=___________。
②T1 温度下,要减少 NO2 的分解率,并缩短达到平衡的时间,可采取的单一措施有______
③平衡常数KT1 ______ KT2 填“大于”“小于”或“等于”,下同);反应速率υa_______υb。
④计算 c 处υ正/υ逆=______。
(3)NO 也 可 通 过 如 下 反 应 处 理 :6NO(g)+4NH3(g) =5N2(g) +6H2O(g);一定条件下,平衡时 N2 的体积分数与压强的关系如图所示。N2 的体积分数先减小后增大的原因是______。
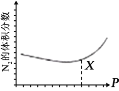
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com