
科目: 来源: 题型:
【题目】实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。
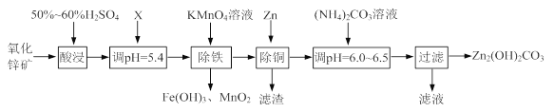
(1)“酸浸”时保持H2SO4过量的目的是_____。
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式:_____。
②流程中调节pH=5.4所加试剂X为_____(填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由_____。
(3)上述流程中的“滤液”可以用作化肥,该滤液的主要成分为_____(填化学式)。
(4)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为_____。

查看答案和解析>>
科目: 来源: 题型:
【题目】若mg Na在足量氯气中燃烧,生成固体的质量为(m+3.55)g,则mg Na与氧气反应,生成固体的质量为( )
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.6)g ⑤(m+1.4)g
A.仅①④B.仅①⑤C.仅③④D.①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为______。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:______________法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是______。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
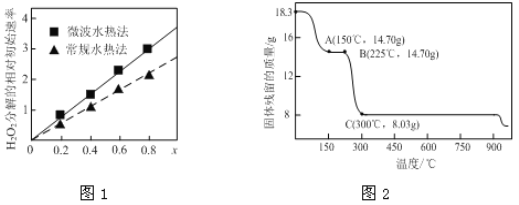
①通过计算确定A点剩余固体的化学成分为________________(填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:_________________________________________。
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)葡萄酒中SO2最大使用量为0.25 g·L-1,取300.00 mL葡萄酒,通过适当的方法使 所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定。
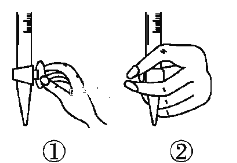
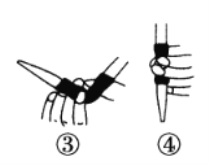
①滴定前排气泡时,应选择下图中的________(填序号)。
②若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积___(填序号)。
①=10 mL ②=40 mL ③<10 mL ④>40 mL。
③上述滴定实验中,可选择___为指示剂,选择该指示剂时如何判断反应到达滴定终点:_____。
④滴定终点读数时俯视刻度线,则测量结果比实际值________(填“偏高”、“偏低”或“无影响”)。
(2)某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作为:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点并记下刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①正确操作步骤的顺序是(用序号字母填写)___________________________
②根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一瓶无色澄清的溶液,其中可能含NH4+、K+、Na+、Mg2+、H+、Cu2+、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用PH试纸检验,表明溶液呈强酸性
②取部分溶液,加入少量的CCl4及数滴新制的氯水,振荡后CCl4层显紫色
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的有___________,肯定不存在的离子有__________________。
(2)写出实验②中的离子反应方程式________________________。
(3)不能确定是否存在的离子有__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为______。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为_______。
(3)与CN-互为等电子体的一种分子为______(填化学式);1mol Fe(CN)63-中含有σ键的数目为______。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于_______(填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为_______。
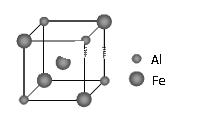
查看答案和解析>>
科目: 来源: 题型:
【题目】已知 A 是单质,A、B、C、D、E 五种物质均含同一种元素,X 是地壳中含量最多的元素形成的单质,相互转化关系如图所示.回答下列问题:

(1)通常情况下,若A为气体,C、D都是大气污染物;
①写出下列反应的化学方程式
B![]() C_________________
C_________________
E![]() C_________________
C_________________
②实验室中检验B的操作方法是_________________。
③标准状况下,将盛满D的试管倒扣在盛满水的水槽中,一段时间后,假定溶质不扩散,则试管中所得溶液的物质的量浓度为____________。
(2)通常情况下,若A为淡黄色固体:
①写出B与C反应的化学方程式:_______________________。
②将C通入溴水中的现象是______,发生反应的离子方程式是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我们已经学过氢气、氧气、二氧化碳、氯气、二氧化硫、氨气等气体的制备方法和化学性质.以下是实验室制备、洗涤、干燥气体及进行尾气处理的常见仪器装置.请结合所学知识回答下列问题:
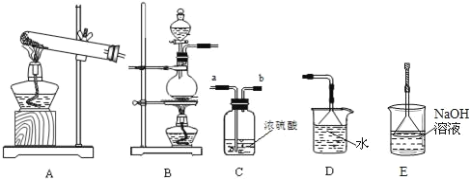
(1)下列气体中,只能用碱石灰干燥的是 ______ (填字母)
A.H2B.Cl2C.SO2D.O2
(2)实验室制取氯气反应原理的离子方程式是______,所选制备装置是______。检验氯气用______试纸;尾气处理的离子方程式为___________。
(3)实验室用氯化铵和熟石灰制取氨气,其化学反应方程式____________。工业上用氯气与石灰乳反应制备漂白粉的化学方程式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题
(1)请写出一定条件下 Cu 与浓硫酸反应制取二氧化硫的化学方程式:___________。该反应中发生氧化反应的物质是__________,1mol氧化剂得到__________mol电子。
(2)PH< ______的雨称为酸雨。向煤中加入适量的______可大大减少燃烧产物中二氧化硫的含量。
(3)一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知常温时,0.1 mol/L醋酸在水中有0.1%发生电离,则该溶液的pH=__,醋酸的电离平衡常数K=__。
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
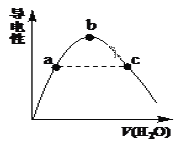
① a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_____________。
② a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a 点溶液中的c(CH3COO-) __c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8 | Ka1=4.3 | Ka=3.0 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com