
科目: 来源: 题型:
【题目】在容积一定的密闭容器中,反应2A![]() B(g) +C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
B(g) +C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
A. 正反应是吸热反应,且A不是气态
B. 正反应是放热反应,且A是气态
C. 其他条件不变,加入少量A,该平衡向正反应方向移动
D. 改变压强对该平衡的移动无影响
查看答案和解析>>
科目: 来源: 题型:
【题目】用“银-Ferrozine”法测室内甲醛含量的原理为:

已知:吸光度与溶液中有色物质的浓度成正比
下列说法正确的是
A. 反应①中参与反应的HCHO为30g时转移电子2mol
B. 可用双氧水检验反应②后的溶液中是否存在Fe3+
C. 生成44.8 LCO2时反应②中参加反应的Ag一定为8mol
D. 理论上测得溶液吸光度越高,HCHO含量也越高
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关胶体的说法中,正确的是( )
A.根据是否具有丁达尔现象,将分散系分为溶液、浊液和胶体
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.将Fe(OH)3胶体和泥水分别过滤,发现均不能通过滤纸孔隙
D.用光束分别照射稀豆浆、FeCl3溶液都可以观察到丁达尔现象
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出下列离子方程式相对应的化学方程式
① Ca2+ + CO32- = CaCO3↓ 化学方程式:____________________________________________________________
② Cu2+ + Fe = Fe2+ + Cu 化学方程式:_____________________________________________________________
(2)制印刷电路时常用氯化铁溶液。铜被氯化铁溶液腐蚀的方程式为2FeCl3+Cu=2FeCl2+CuCl2,其中氧化剂是_________,氧化产物是________。写出离子方程式并用双线桥标出电子得失:________________。
(3)除去氯化铁溶液中的氯化亚铁所用试剂________(填化学式),发生的离子反应方程式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:据此回答下列问题:
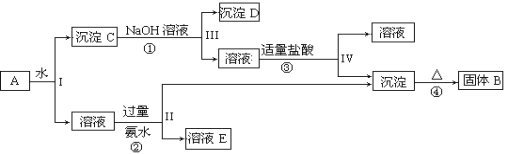
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是____________。
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式B_________;沉淀D __________;溶液E__________。
(3)写出①、②、③、④四个反应方程式或离子方程式:
①___________________________________;
②___________________________________;
③___________________________________;
④___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼氢化钠(NaBH4)是有机合成中常用的还原剂。一种制备硼氢化钠工艺如下(部分条件和产物省略):
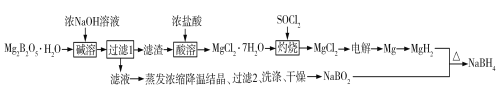
已知:MgH2、NaBH4遇水蒸气剧烈反应并放出H2。
回答下列问题:
(1)Mg2B2O5H2O中B的化合价为_______________。MgH2和NaBO2必须在干燥条件下合成硼氢化钠,其原因是_____________________________________________。
(2)难溶的Mg2B2O5与浓氢氧化钠溶液反应的离子方程式为__________。
(3)SOCl2溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧时加入SOCl2的目的是______________________________。
(4)已知镁—H2O2酸性燃料电池反应为Mg+H2O2+H2SO4![]() MgSO4+2H2O。常温下,电解质溶液为200 mL 0.1 mol·L1硫酸溶液。
MgSO4+2H2O。常温下,电解质溶液为200 mL 0.1 mol·L1硫酸溶液。
①写出正极的电极反应式:______________________________。
②若电路中有0.038 mol转移电子时,则溶液pH约为_____(忽略体积变化,不考虑H2O2电离)。
(5)“有效氢”是衡量含氢还原剂的还原能力指标,定义为1 g含氢还原剂的还原能力与多少克H2相当。NaBH4的“有效氢”等于_________________(结果保留2位小数)。
(6)工业上,可以利用NaBO2、HCHO和生石灰在加热下生成NaBH4和难溶的盐,写出化学方程式________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】酯类物质是极为重要的有机合成产品或中间产物,结构简式为(![]() )的酯类有机物 E(核磁共振氢谱有3 个峰)是一种重要的塑化剂,工业上合成 E 的路线如下图所示:
)的酯类有机物 E(核磁共振氢谱有3 个峰)是一种重要的塑化剂,工业上合成 E 的路线如下图所示:
⑴烃 A 的名称_________,E 的分子式为_____,C 中官能团的结构简式为_____。
⑵④的反应条件为_____,上述转化中属于取代反应的是_____。
⑶②的化学方程式为_____。
⑷B 有很多同分异构体,其中苯环上有三个取代基且遇 FeCl3 溶液显紫色的物质共有_____种;写出分子中有 5 种不同化学环境的氢原子的结构简式__________________________________。
⑸已知R-CH=CH2 ![]() RCH2CHO,写出以CH2=CH2和H218O为原料(其他无机试剂任选)合成
RCH2CHO,写出以CH2=CH2和H218O为原料(其他无机试剂任选)合成![]() 的合成路线图______________________________________________(仿照题目中形式,不要编号)
的合成路线图______________________________________________(仿照题目中形式,不要编号)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应4CO+2NO2![]() N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A. υ(CO)=1.5 mol·L-1·min-1 B. υ(NO2)=0.7 mol·L-1·min-1
C. υ(N2)=0.4 mol·L-1·min-1 D. υ(CO2)=1.1 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下图装置是用燃烧法确定有机物M分子式的常用装置。
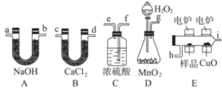
(1)产生的氧气按从左到右方向流动,所选装置各导管的连接顺序是______________________;
(2)C装置中浓硫酸的作用是___________________;
(3) 若准确称取有机物M (只含C、H、O三种元素中的两种或三种) 0.70 g,经充分燃烧后,A管质量增加2.2 g,B管质量增加0.9 g,则该有机物的实验式为__________________;
(4)已知在相同条件下该M蒸气相对氢气的密度为35,则M的分子式为_____________。若有机物M不能使溴水褪色,且其核磁共振氢谱只有一个吸收峰,则M的结构简式为________________。若该有机物M分子中所有碳原子一定都在同一平面内,且能使溴水褪色,在催化剂作用下能与H2加成,其加成产物分子中含有3个甲基,则M的结构简式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com