
科目: 来源: 题型:
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
科目: 来源: 题型:
【题目】资源回收利用意义重大,镀锌废铁屑(表面附有锌皮、少量铁锈及油污)有很多用途,某工厂综合利用镀锌废铁屑的工艺如下图。请回答:

(1)用氢氧化钠溶液浸泡废铁屑的目的是_________。
(2)下列物质中最适合充当氧化剂A的是_______(填标号)。
A. KMnO4 B. Cl2 C.H2O2 D. HNO3
(3)聚合硫酸铁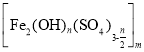 是水处理中重要的絮凝剂,聚合釜中主要发生“水解”和“聚合”两个过程,“水解”时反应的化学方程式为__。聚合釜中溶液的pH必须控制在一定的范围内,pH偏小Fe3+水解程度弱,pH偏大则__;相对于常压蒸发,减压蒸发的优点是__。
是水处理中重要的絮凝剂,聚合釜中主要发生“水解”和“聚合”两个过程,“水解”时反应的化学方程式为__。聚合釜中溶液的pH必须控制在一定的范围内,pH偏小Fe3+水解程度弱,pH偏大则__;相对于常压蒸发,减压蒸发的优点是__。
(4)纳米Fe3O4,可用于改善石墨烯材料的性能。制得溶液B时加入的氧化剂A需适量,原因是_____。
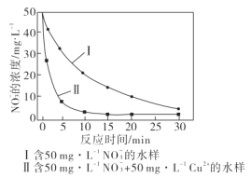
(5)废铁屑也能用来生产纳米铁粉,纳米铁粉能够去除地下水中的NO3-,反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O,研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是__。相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见下图),产生该差异的可能原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求写方程式
(1)过氧化钠与水的离子方程式_________________。
(2)氢氧化亚铁在空气中被氧化的化学方程式___________。
(3)氢氟酸刻蚀玻璃的化学方程式____________________。
(4)除去Na2CO3固体中混有的NaHCO3的化学方程式____________。
(5)除去FeCl2溶液中混有的FeCl3的离子方程式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据氯水分别与右图中四种物质发生的反应 (a、b、c、d重合部分代表物质间可反应,且氯水足量)。能证明氯水具有漂白性的是( )

A.aB.bC.cD.d
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方法适合实验室制取氨气的是( )
A.N2和H2催化加热制取氨气
B.加热NH4Cl制取氨气
C.将浓氨水加入到碱石灰固体中
D.将NH4Cl溶液和NaOH溶液混合
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室进行氨溶于水的喷泉实验装置,下列叙述不正确的是( )
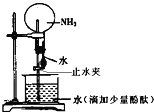
A.该实验说明氨气是一种极易溶于水的气体
B.进入圆底烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性
C.形成喷泉的原因是氨气溶于水后,圆底烧瓶内的气压小于外界大气压
D.用氢气代替氨气,利用此装置也可进行喷泉实验
查看答案和解析>>
科目: 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL该溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到气体0.08mol;
③第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。根据上述实验,回答下列问题:
(1)由第二份进行的实验得知混合物中应含有___________离子,其物质的量浓度为________。
(2)由第三份进行的实验可知12.54克沉淀的成分是______________(写沉淀化学式),其物质的量分别为______________________。
(3)原溶液中是否存在K+_______填“是”或“否)若存在则K+的浓度的取值范围是____________________(若不存在此空可不填)
查看答案和解析>>
科目: 来源: 题型:
【题目】将V1 mL 1.00mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是

A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】一种常用的镇静、麻醉药物I,其合成路线如下。
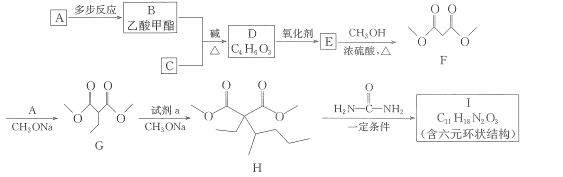
已知:①B、C互为同分异构体
②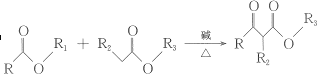 +R1OH;
+R1OH;
③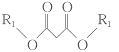 +R3Br+CH3ONa
+R3Br+CH3ONa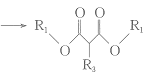 +CH3OH+NaBr;
+CH3OH+NaBr;
④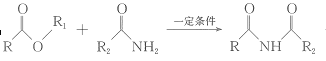 + R1OH;
+ R1OH;
其中 R、R2代表烃基或氢原子,R1、R3代表烃基。回答下列问题。
(1)试剂a为溴代物,其名称为_____,G中官能团的名称为____,G-H的反应类型为____。
(2)I的结构简式为__。
(3)写出 B+C→D的化学方程式:__________________
(4)设计实验区分B、D,所选用的试剂为___________________。
(5)已知羟基与碳碳双键直接相连的结构不稳定,同一个碳原子上连接多个羟基的结构不稳定,满足下列要求的D的所有同分异构体共有______种,写出其中互为顺反异构物质的结构简式:___________。
a.能发生银镜反应;b.能发生水解反应;c.能使Br2的CCl4溶液褪色;d.能与Na反应。
(6)参照上述合成路线,请写出以 CH2BrCH2CH2Br、CH3OH、CH3ONa 为原料(无机试剂任选),制备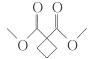 的合成路线:____________________________。
的合成路线:____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某草酸亚铁水合物A可用于制作照相显影剂、制药等。下面是对该化合物的制备及分析的实验方案。

请回答下列问题。
(1)硫酸亚铁的制备及收集纯净的氢气:将2.00g铁粉(含少量FeS及其他难溶性杂质)放入150mL锥形瓶中,加入25mL 3 mol/L H2SO4,水浴加热。反应完毕趁热过滤,反应装置如下图所示(每个装置限用一次)。
①使用以上装置完成实验,指出装置连接顺序:a______________。
②反应完毕后趁热过滤的目的是________________________。
(2)草酸亚铁水合物A的制备:将滤液转移至事先已盛有50 mL 1 mol/L H2C2O4溶液的250mL烧杯中,搅拌下加热至沸腾,一段时间后得到淡黄色沉淀(其主要成分为A)。
①已知A中铁的质量分数为31%,其化学式为____________。
②3.6g A 在无氧条件下加热,最终得到1.44g 固体化合物,试写出该过程中发生反应的化学方程式:___________________________。
③若对实验方案中的硫酸加入量略作调整,可以得到更高产率的A,试用化学平衡的相关知识分析,并指出该调整是增加还是减少硫酸的量:________。
(3)草酸亚铁水合物A纯度的测定:称取mg产物于100mL烧杯中,用2 mol/L H2SO4溶解,转移至250 mL容量瓶中并用2 mol/L H2SO4定容。移取25.00mL溶液至 250 mL 锥形瓶中,微热后用浓度为c mol/L的标准高锰酸钾溶液滴定,平行测定三次,平均消耗滴定剂VmL(假设杂质不参与滴定反应)。
①写出滴定过程中发生反应的离子方程式:___________________________ ;
②列出表示产物中A的纯度的计算式:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com