
科目: 来源: 题型:
【题目】据《自然·通讯》(Nature Communications)报道,我国科学家发现了硒化铜纳米催化剂在二氧化碳电化学还原法生产甲醇过程中催化效率高。铜和硒等元素化合物在生产、生活中应用广泛。
请回答下列问题:
(1)基态硒原子的价电子排布式为________;硒所在主族元素的简单氢化物中沸点最低的是________。
(2)电还原法制备甲醇的原理为2CO2+4H2O![]() 2CH3OH+3O2。
2CH3OH+3O2。
①写出该反应中由极性键构成的非极性分子的结构式________;
②标准状况下,V L CO2气体含有________个π键。
(3)苯分子中6个C原子,每个C原子有一个2p轨道参与形成大π键,可记为(π![]() 右下角“6”表示6个原子,右上角“6”表示6个共用电子)。已知某化合物的结构简式为
右下角“6”表示6个原子,右上角“6”表示6个共用电子)。已知某化合物的结构简式为![]() ,不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,可表示为_______,Se的杂化方式为________。
,不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,可表示为_______,Se的杂化方式为________。
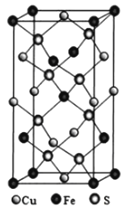
(4)黄铜矿由Cu+、Fe3+、S2-构成,其四方晶系晶胞结构如图所示。则Cu+的配位数为________;若晶胞参数a=b=524pm,c=1032pm,用NA表示阿伏加德罗常数的值,该晶系晶体的密度是________g·cm-3(不必计算或化简,列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学平衡是最重要的化学反应原理之一。
(1)现有容积为1L的恒温恒容密闭容器,向其中加入1molA气体和1molB气体后发生反应:A(g)+B(g)![]() C(g) ΔH=-qkJ·mol-1(q>0),ts后,反应达到平衡状态,生成0.5molC气体,放出热量Q1kJ。回答下列问题:
C(g) ΔH=-qkJ·mol-1(q>0),ts后,反应达到平衡状态,生成0.5molC气体,放出热量Q1kJ。回答下列问题:
①在题干条件下,说明该反应已经达到平衡状态的有__(填序号)。
A.消耗0.1molA的同时生成0.1molC
B.容器中气体的压强不随时间而变化
C.容器中气体的密度不随时间而变化
D.A的转化率为50%
②保持容器温度和容积不变,若开始时向容器中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1、Q2与q的数值关系正确的是___(填序号)。
A.Q1+Q2=q B.Q1+2Q2<q C.Q1+2Q2>q D.Q1+Q2<q
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入amolA气体,重新达平衡后,B气体的转化率为75%,则a=__。
(2)在一容积可变的密闭容器中充有10molCO和20molH2,发生CO(g)+2H2(g)![]() CH3OH(g)反应。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)反应。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。

①A、B、C三点的平衡常数KA、KB、KC的大小关系为___。
②若达到平衡状态A时,容器的体积为8L,则在平衡状态B时容器的体积为___L。
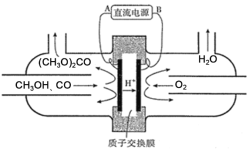
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。则电源的正极为___(填“A”或“B”),写出阳极的电极反应式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学学习小组分别设计了一组实验来探究元素周期律。
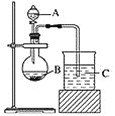
第一小组根据元素非金属性与其对应最高价含氧酸之间的关系,设计了如图装置来一次性完成同主族元素非金属性强弱比较的实验探究。
[查阅资料]
Ⅰ.常温下浓盐酸与高锰酸钾能反应生成氯气。
Ⅱ.H2SiO3难溶于水。
实验药品:大理石、碳酸钠粉末、稀硝酸、硅酸钠溶液。
[探究过程]
(1)第一小组为比较N、C、Si的非金属性强弱,以图中装置进行实验:
①烧杯C中现象为__________,发生反应的离子方程式为________________。
②实验预期结论:_______________________________________。
③存在问题:___________________________________________。
(2)第二小组设计了下图装置来验证卤素单质的氧化性,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
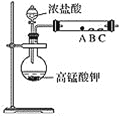
①写出A处反应的离子方程式:_______________________________。
②B处实验现象是____________________________________________。
③实验预期结论:____________________________________________。
④存在问题:________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I. CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_________,判断该反应是_____________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:_________,判断该反应是_____________反应(填“吸热”或“放热”)。
II. T1温度下,体积为2L的恒容密闭容器,加入4.00molX,2.00molY,发生化学反应 2X(g)+Y(g) ![]() 3M(g)+N(s) △H<0。
3M(g)+N(s) △H<0。
部分实验数据如下:
t/s | 0 | 500 | 1000 | 1500 |
n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
(2)当反应达到平衡后,其他条件不变,分离出部分M,则新平衡时,正反应速率相对于原平衡____________(填“增大”、“减小”、或“不变”)。
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些____。

a.Y的逆反应速率
b.M的体积分数
c.混合气体的密度
d.X的转化率
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____________。
A.重新达平衡后,用X表示的υ(正)比原平衡大
B.重新达平衡后,M的体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度____________1.5mol/L(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是( )
A.对比②③,可以判定Zn保护了Fe
B.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
C.验证Zn保护Fe时不能用①的方法
D.对比①②,K3[Fe(CN)6]可能将Fe氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向40mL0.05mol/L的FeCl3溶液中一次性加入10mL0.15mol/L的KSCN溶液,发生反应,混合溶液中c(Fe3+)与反应时间(t)的变化如图所示。下列说法正确的是( )
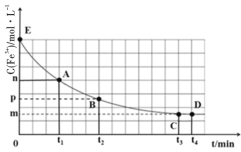
A.该反应的离子方程式为Fe3++3SCN-![]() Fe(SCN)3↓
Fe(SCN)3↓
B.E点对应的坐标为(0,0.05)
C.t4时向溶液中加入50mL0.1mol/LKCl溶液,平衡不移动
D.若该反应是可逆反应,在25℃时平衡常数的数值为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
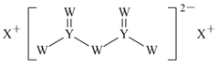
A.熔点:Y单质高于X单质
B.元素非金属性强弱的顺序为W>Y>Z
C.W的简单氢化物稳定性比Y的简单氢化物稳定性低
D.W分别与X、Y、Z形成的二元化合物均只有两种
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
容器 | 温度/℃ | 起始物质的量浓度/(mol·L-1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T2 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
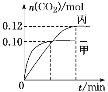
反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示。下列说法正确的是
A.该反应的正反应为放热反应,平衡常数K(T1)<K(T2)
B.乙容器中反应达到平衡时,N2的转化率小于40%
C.达到平衡时,乙容器中的压强一定大于甲容器的2倍
D.丙容器中反应达到平衡后,再充入0.10 mol NO和0.10 mol CO2,此时υ(正)<υ(逆)
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.1mol硝基(-NO2)与46gNO2所含的电子数均为23NA
B.1mol环己烷中含有共价键数为12NA
C.向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,转移的电子数为NA
D.电解精炼铜时,若转移了NA个电子,则阳极质量减小32g
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图所示。
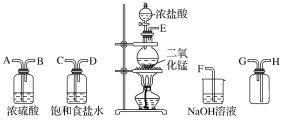
(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接___;__接__。
(2)装置中,饱和食盐水的作用是___;NaOH溶液的作用是___。
(3)化学实验中常用湿润的KI-淀粉试纸检验是否有Cl2产生。如果有Cl2产生,可观察到___,反应的化学方程式为___。
(4)写出下列反应的化学方程式:
①气体发生装置中进行的反应:___。
②NaOH溶液中发生的反应:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com