
科目: 来源: 题型:
【题目】下列化学反应方程式对应的离子方程式正确的是
A.CuCO3+2NaOH=Cu(OH)2↓+Na2CO3 Cu2++2OH-=Cu(OH)2↓
B.Ba(OH)2+H2SO4=BaSO4↓+2H2O Ba2++SO![]() =BaSO4↓
=BaSO4↓
C.AgNO3+NaCl=AgCl↓+NaNO3 Ag++Cl-=AgCl↓
D.Cu(OH)2+H2SO4=CuSO4+2H2O OH-+H+=H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】最近,全国的雾霾天气对环境造成了严重影响,芜湖市开展了和臭氧的监测。 下列有关说法正确的是
A. 臭氧的摩尔质量是 48g
B. 同温同压条件下,等质量的氧气和臭氧体积比为 2:3
C. 20g 氖气中含有个 6.02 × 1023 个原子
D. 1.00mol 臭氧中含有电子总数为 18 × 6.02 × 1023个
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L H2O中含有氢原子数目为2NA
B.17 g NH3所含质子数为10NA
C.0.1 mol Cu(NO3)2中含有的离子数目为0.2NA
D.28 g N2体积为22.4L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a. 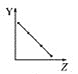 b.
b. 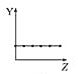 c.
c. 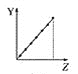 d.
d. 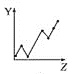
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为·![]() ·,B原子L层的电子总数是K层的3倍,0.1 mol C单质能从酸中置换出2.24 L(标准状况)氢气,同时它的电子层结构变成与氖原子相同的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
·,B原子L层的电子总数是K层的3倍,0.1 mol C单质能从酸中置换出2.24 L(标准状况)氢气,同时它的电子层结构变成与氖原子相同的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
(1)写出A、B、C、D元素的名称:A________,B______,C________,D________。
(2)D元素在周期表中属于第________周期______族。
(3)用电子式表示A的气态氢化物的形成过程:____________。
(4)A和B的单质充分反应生成的化合物的结构式是___________。
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明?_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】计算:
(1)室温下,0.001mol/L的盐酸溶液的PH=____;加水稀释到原来的10倍,pH=_____
(2)室温下,pH=3的CH3COOH溶液加水稀释到原体积的10倍,溶液的pH值范围_____;
(3)室温下,pH=1和pH=3的硫酸等体积混合后溶液的pH=_____(lg2=0.3、lg3=0.477、lg5=0.7)
(4)在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L的氢氧化钠溶液混合后,溶液的pH=___
(5)25![]() 时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为____
时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为____
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A→C必须加热,否则会发生钝化现象。请回答下列问题:
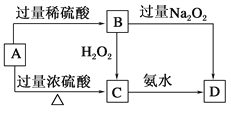
(1)A是________,你推断的理由是___________________。
(2)B在酸性条件下与H2O2反应的离子方程式:_____________________。
(3)A与过量浓H2SO4反应的化学方程式:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图所示装置回答以下问题。已知:①KMnO4常温下与浓盐酸反应可制得Cl2。②H2SiO3不溶于水。
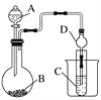
(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是________________。干燥管D的作用是____________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为____________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为________(填序号);试管中发生反应的离子方程式为__________________。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物M是生产治疗皮肤病药物的中间体。实验室由芳香族化合物A制备M的一种合成路线如图:
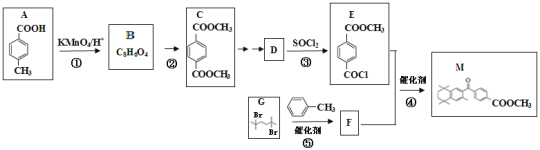
已知:①RCOOH![]() RCOCl
RCOCl
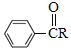
②![]()
![]()
![]() (R表示烃基)
(R表示烃基)
回答下列问题:
(1)B的化学名称为___。
(2)反应②试剂和条件分别为___。
(3)③的反应类型是___。
(4)M中含氧官能团的名称是___。
(5)反应⑤的化学方程式为___。
(6)写出同时满足下列条件,与D互为同分异构体的芳香族化合物的结构简式___(任写两种)。
ⅰ.能与NaHCO3溶液反应;
ⅱ.能发生银镜反应;ⅲ.核磁共振氢谱中的峰面积之比为1:2:2:2:1。
(7)参照上述合成路线和信息,以苯和一溴甲烷为原料(无机试剂任选),设计制备![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com