
科目: 来源: 题型:
【题目】甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得甲、乙两烧杯中生成的气体体积之比为2:3,则加入的铝粉质量可能为( )
A.8.1gB.3.6gC.5.4gD.4.05g
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
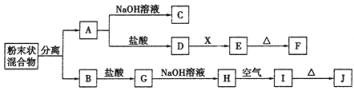
(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
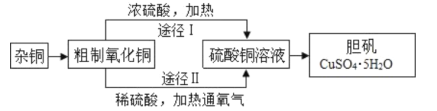
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于___上(用以下所给仪器的编号填入,下同),取用坩埚应使用____,灼烧后的坩埚应放在___上,不能直接放在桌面上;实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹;
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾,灼烧后含有少量铜的可能原因是____;
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径 II 实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、____、冷却结晶、___、自然干燥;
(4)由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径II有明显的两个优点是: ____、____;
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行___次;
(6)若测定结果x值偏高, 可能的原因是___。
a.加热温度过高 b.胆矾晶体的颗粒较大 c.加热后放在空气中冷却 d.胆矾晶体部分风化
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可由![]() 、
、![]() 、
、![]() 为原料制备
为原料制备![]() ,若反应后废液中的
,若反应后废液中的![]() 排入水中,则过量的氮元素会使水体富营养化。此外考虑到其他污染源,污水一般还会含有
排入水中,则过量的氮元素会使水体富营养化。此外考虑到其他污染源,污水一般还会含有![]() 、
、![]() 、
、![]() 等。
等。
(1)已知![]() 化学式可表示为
化学式可表示为![]() ,由常温下逐渐升温的过程中会发生分解。已知起始状态到A点是失去了部分结晶水,B点对应的物质是钒的氧化物,如下图所示。
,由常温下逐渐升温的过程中会发生分解。已知起始状态到A点是失去了部分结晶水,B点对应的物质是钒的氧化物,如下图所示。
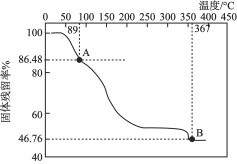
①写出起始状态到A点发生分解反应的化学方程式:________________。
②B点对应物质的化学式是______________。
(2)废水中![]() 和
和![]() 的处理。通过形成铁炭(铁和活性炭)原电池可对废水中的有机物及含氮物质等进行处理,将酸性废水中以
的处理。通过形成铁炭(铁和活性炭)原电池可对废水中的有机物及含氮物质等进行处理,将酸性废水中以![]() 和
和![]() 形式存在的氮元素转化为
形式存在的氮元素转化为![]() 除去。
除去。
①写出![]() 在正极发生的电极反应式______________。
在正极发生的电极反应式______________。
②不同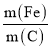 的脱氮效果如图1所示,则合适的
的脱氮效果如图1所示,则合适的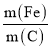 =________。
=________。
③实验测得当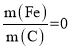 时,对废水中的氮也有一定的脱除率,其原因为________。
时,对废水中的氮也有一定的脱除率,其原因为________。
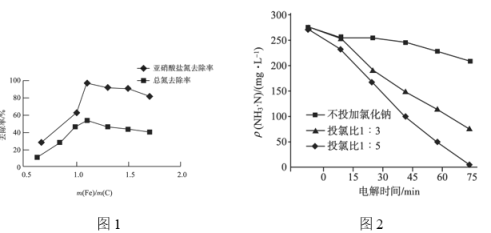
(3)废水中![]() 的处理。用电解法可对废水进行脱氮处理。
的处理。用电解法可对废水进行脱氮处理。
①电解时含氯离子转化为次氯酸,![]() 与
与![]() 反应生成
反应生成![]() ,当生成
,当生成![]() 时,转移的电子数为________mol。
时,转移的电子数为________mol。
②氯离子含量对废水脱氮效果的影响如图2所示,投氯比是指氨氮与氯离子物质的量的比,三种情况下投料为![]() 时脱氮效果________(填“最好”“最差”或“居中”),原因可能是________。
时脱氮效果________(填“最好”“最差”或“居中”),原因可能是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据实验室测定硫酸铜晶体结晶水含量的实验,填写下列空白:
(1)从下列仪器中选出所需仪器(用标号字母填写)_____;
A.电子天平 B.研钵 C.药匙 D.酒精灯 E.干燥器 F.玻璃棒 G.石棉网 H.蒸发皿 I.坩埚 J.三脚架
除上述仪器外,还需要的仪器是____;
(2)某学生实验后得到以下数据:
加热前的质量(g) | 加热前的质量(g) | ||
W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) | |
第一次 | 15.688 | 17.668 | 16.962 |
第一次 | 15.688 | 17.744 | 17.002 |
请写出结晶水x=___(保留2位小数),实验误差=_____%(保留2位小数);
从下列选项中选出该学生产生误差的原因可能是(填写字母)____。
A.加热前称量时容器未完全干燥 B.晶体表面已经少量失水
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失
查看答案和解析>>
科目: 来源: 题型:
【题目】 [实验化学]
3,4亚甲二氧基苯甲酸是一种用途广泛的有机合成中间体,微溶于水,实验室可用KMnO4氧化3,4亚甲二氧基苯甲醛制备,其反应方程式为

实验步骤如下:
步骤1:向反应瓶中加入3,4亚甲二氧基苯甲醛和水,快速搅拌,于70~80 ℃滴加KMnO4溶液。反应结束后,加入KOH溶液至碱性。
步骤2:趁热过滤,洗涤滤饼,合并滤液和洗涤液。
步骤3:对合并后的溶液进行处理。
步骤4:抽滤,洗涤,干燥,得3,4亚甲二氧基苯甲酸固体。
(1)步骤1中,反应结束后,若观察到反应液呈紫红色,需向溶液中滴加NaHSO3溶液,![]() 转化为_____________(填化学式);加入KOH溶液至碱性的目的是____________________________。
转化为_____________(填化学式);加入KOH溶液至碱性的目的是____________________________。
(2)步骤2中,趁热过滤除去的物质是__________________(填化学式)。
(3)步骤3中,处理合并后溶液的实验操作为__________________。
(4)步骤4中,抽滤所用的装置包括_______________、吸滤瓶、安全瓶和抽气泵。
查看答案和解析>>
科目: 来源: 题型:
【题目】葡萄糖酸锌是一种常见的补锌药物,常用葡萄糖酸和![]() 反应制备。
反应制备。
(1)![]() 基态核外电子排布式为________。
基态核外电子排布式为________。
(2)![]() 的空间构型为________(用文字描述);
的空间构型为________(用文字描述);![]() 与
与![]() 反应能生成
反应能生成![]() ,不考虑空间构型,
,不考虑空间构型,![]() 的结构可用示意图表示为________。
的结构可用示意图表示为________。
(3)葡萄糖酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为________;推测葡萄糖酸在水中的溶解性:________(填“难溶于水”或“易溶于水”)。
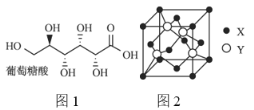
(4)用![]() 可以制备
可以制备![]() ,一个
,一个![]() 晶胞(如图2)中,
晶胞(如图2)中,![]() 的数目为________。
的数目为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业中的用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-===2NO2-+H2O;
②气体液化的温度:NO2为21 ℃,NO为-152 ℃。
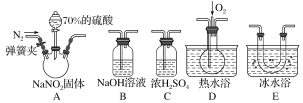
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、________、________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是________________________________________________________________________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是________________________。
②装置E的作用是_________________________________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为___________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com