
科目: 来源: 题型:
【题目】下列关于0.1mol/LH2SO4溶液的叙述错误的是
A.1L该溶液中含有H2SO4的质量为9.8g
B.0.5L该溶液中氢离子的物质的量浓度为0.2mol/L
C.从1L该溶液中取出100mL,则取出的溶液中H2SO4的物质的量浓度为0.01mol/L
D.取该溶液10mL加水稀释至100mL后,H2SO4的物质的量浓度为0.01mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.常温常压下,1.7gNH3含有NA个电子
B.标准状况下,22.4L水中含H2O分子NA个
C.1molNa完全反应生成NaCl时,失去NA个电子
D.常温常压下,22.4LCO2中含有的CO2分子数小于NA个
查看答案和解析>>
科目: 来源: 题型:
【题目】根据反应:2Na2CO3+SnO2+4S![]() Na2SO4+Na2SnS3+2CO2↑。回答下列问题:
Na2SO4+Na2SnS3+2CO2↑。回答下列问题:
(1)上述反应涉及的元素中,非金属性最强的元素的最外层电子排布式为_____________,在上述反应的生成物中,属于分子晶体的的电子式__________。
(2)反应中单质物质的原子核外共有______种不同形状的电子云,该原子最外层电子的能量 ______上述方程式中同主族的另一元素原子的最外层电子能量(选填“高于”“低于”或“等于”)。
(3)上述反应中,金属性最强的元素与铝元素相比较,可作为判断金属性强弱依据的是___(选填编号)。
a.能否置换出铝盐溶液中铝
b.Al(OH)3能否溶解在该元素最高价氧化物对应水化物中
c.单质与氢气化合的难易程度
d.单质与同浓度的稀盐酸发生反应的快慢程度
(4)常温下,Na2CO3溶液比Na2SO4溶液碱性______(选填“强”或“弱”)用离子方程式说明原因:__________________。(选填“冷”或“热”)的纯碱水易于除油污,简要说明原因:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示①②③三个容器,①②容器体积均为VL,③体积为0.5VL,若起始温度相同,分别向①②通入2molA,向③中通入2molB,发生如下反应:2A(g)![]() B(g) △H<0,则达到平衡时各容器内B的体积分数由大到小的顺序为( )
B(g) △H<0,则达到平衡时各容器内B的体积分数由大到小的顺序为( )
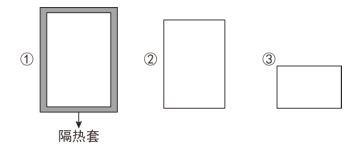
A.①②③
B.③①②
C.③②①
D.②③①
查看答案和解析>>
科目: 来源: 题型:
【题目】某物质由铁和氧两种元素组成,实验测得铁元素与氧元素的质量比为21∶8,关于该物质的下列说法中不正确的是( )
A.铁元素与氧元素物质的量比为3∶4
B.该物质可能为四氧化三铁
C.该物质一定为四氧化三铁
D.该物质可能为混合物
查看答案和解析>>
科目: 来源: 题型:
【题目】碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快速平衡)
2I(g)(快速平衡)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
下列说法错误的是( )
A.升高温度,第一步向右进行的程度变大
B.第二步的活化能大于第三步的活化能
C.总反应为2N2O![]() 2N2+O2
2N2+O2
D.c[IO(g)]对总反应速率的影响大于c[I(g)]
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M是短周期的四种元素,原子序数依次增大。X和M为同一主族元素,Y的最外层电子数为3,Z是地壳中含量最高的元素,X、Y和M三元素可组成MYX4化合物,其结构式如图所示,下列说法错.误.的是( )
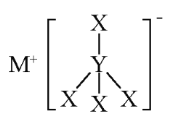
A.MYX4化合物中X的化合价为+1
B.Z与X、M形成的二元化合物均不止一种
C.M在自然界中以化合物形式存在
D.原子半径由大到小顺序为M>Y>Z>X
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可用铁盐溶液溶解黄铁矿(主要成分为FeS2),发生如下过程。下列说法错误的是
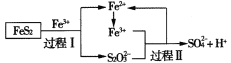
A.过程I每溶解120 g FeS2,理论上消耗6 mol Fe3+
B.过程Ⅱ每生成1 mol SO42-转移8 mol e-
C.总反应为FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
D.反应过程中鼓入大量的空气有利于反应的进行
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.60g冰醋酸和果糖的混合物中含氧原子的数目为2NA
B.标准状况下,33.6LCHCl3中含有的共价键的数目为6NA
C.常温下,将2.7gAl投入足量的浓硝酸中,转移电子数为0.3NA
D.78gH2SiO3胶体中含有的胶粒数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)生产中曾用铝热反应焊接钢轨,铝与氧化铁反应的化学方程式为___________。
(2)复方氢氧化铝治疗胃酸过多时,氢氧化铝表现______性;氢氧化铝的电离方程式_______________。
(3)铁、铝、铁铝合金三种物质中硬度最大的是_________________。
(4)铝锭能做成铝壶烧水,表现铝的导热性和______________,表面破损的铝制品,放久了破损处会有一层“白毛”产生,“白毛”既能溶于酸又能溶于碱溶液,写出形成“白毛”的化学方程式________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com