
科目: 来源: 题型:
【题目】使用胆矾(CuSO45H2O)配制0.1mol/L的硫酸铜溶液,正确的操作是_______
A.将胆矾加热除去结晶水后,称取16g溶解在1L水中
B.称取25g胆矾溶于水,然后将此溶液稀释至1L
C.称取25g胆矾溶解在1L水里
D.将16g胆矾溶于水,然后将此溶液稀释至1L
查看答案和解析>>
科目: 来源: 题型:
【题目】如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3。试回答下列问题:

(1)在A试管内发生反应的化学方程式是___________________。
(2)B装置的作用是_____________________。
(3)在双球干燥管内发生反应的化学方程式为______________________。
(4)双球干燥管内观察到的实验现象是____________________________。
上述实验现象说明____________________________。
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质。现通过下列生产过程,从该样品中回收铁红。流程如下:

(1)操作a是________,在实验室进行该操作需要的玻璃仪器有烧杯、漏斗和_______。
(2)试剂①是_______,固体II是_________(填化学式)。
(3)红褐色沉淀的成分是_________;写出白色沉淀转化为红褐色沉淀的化学方程式:______________。
(4)溶液II中铁元素的存在形式是_______(填离子符号),如何用实验证明:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图ⅠⅣ所示。

(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)___。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为___;与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)___。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)___。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应,
①当石灰水过量时,其离子方程式为:___;
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为___,请设计实验检验所得溶液中溶质的阴离子___。
(5)已知NaHCO3溶液呈碱性,则在该溶液中c(H2CO3)______c(CO32-),其原因是:__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某无色溶液中只含有下列7种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HCO3-、OH-,已知该溶液与铝反应放出氢气,若反应后生成AlO2-,则溶液中一定存在的离子有______________,一定不存在的离子有______________,可能存在的离子有__________________,该溶液与铝反应放出氢气的离子方程式为_____________________________________。
(2)铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,某兴趣小组首先将其制成水溶液。
①通常将氢氧化钠溶液加入氯化亚铁溶液的实验现象是___,
②书写氢氧化亚铁在空气中转化为氢氧化铁的化学方程式___。
(3)在所得的FeCl3、CuCl2混合溶液中加入镁粉,产生的气体是___。试解释原因:___。有同学提出加入CuO以除去Fe3+。你认为理由是___。
(4)能不能直接蒸发CuCl2溶液得到CuCl2·2H2O晶体?___(填“能”或“不能”)。若能,不用回答;若不能,说明理由___。
(5)将FeCl3固体溶于蒸馏水配制溶液时常会出现浑浊,得不到澄清的氯化铁溶液,其原因是___,如果要得到澄清的氯化铁溶液,可采取的措施是___。
(6)泡沫灭火器使用NaHCO3和Al(SO4)3溶液反应产生CO2来灭火。试从平衡移动的角度分析以上两种溶液反应产生CO2的原因:____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ba(AlO2)2可溶于水,下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是( )
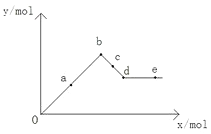
A.a-b时沉淀的物质的量:Al(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:Ba2+比AlO2-多
C.a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】现有200 mL MgCl2和AlCl3混合溶液,其中Mg2+浓度0.2mol/L、 Cl-浓度为1.3 mol/L。要使Mg2+转化成Mg(OH)2并使Mg2+、Al3+分离开来,至少需要4 mol/L NaOH溶液( )
A. 80mLB. 100mLC. 120mLD. 140mL
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原是一类重要的反应。
(1)某同学写出以下三个化学方程式(未配平)
①N2O4+H2O→HNO3+HNO2 ②NO+HNO3→N2O3+H2O ③NH3+NO→HNO2+H2O
其中你认为一定不可能实现的是(填代号)____________;
(2)以下反应中H2O2仅体现还原性的是(填代号)____________,H2O2既体现氧化性又体现还原性的是(填代号)____________,从反应中判断H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是_______________;
A.H2O2+2Fe2++2H+=2Fe3++2H2O
B.2H2O2=2H2O+O2↑
C.Ag2O+H2O2=2Ag+O2↑+H2O
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4=MnO2+H2SO4
(3)用“双线桥法”标明以下反应中电子转移的方向和数目________,若反应中有3.01×1023个电子转移,则被氧化的还原剂的物质的量为___________。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】我国西安兵马佣二号坑出土的宝剑因含有铬而锋利无比。目前,工业用硬铬尖晶石(属于含氧酸盐,主要含MN2O4其中M代表Mg或Fe,N代表Cr或Al)制备重铬酸钠(工业流程如图),同时电解重铬酸钠溶液便可得到铬。
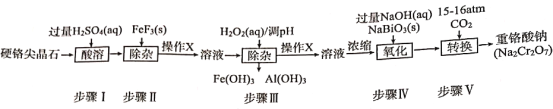
(1)硬铬尖晶石中,Cr的化合价为__。
(2)在步骤II中除去的离子是___,操作X的名称为___。
(3)写出步骤III中H2O2表现的性质是___,已知步骤III所得溶液c(Cr3+)=0.010mol/L,常温下,加NaOH使c(Fe3+)和c(Al3+)均降至10-5mol/L,应控制溶液的pH为___。(常温下:[Ksp[Cr(OH)3]=1.0×10-32,Ksp[Al(OH)3]=1.0×10-35,Ksp[Fe(OH)3]=1.0×10-38]。
A.10~11 B.>11 C.约为10 D.约为4
(4)已知NaBiO3和Bi(OH)3都是难溶于水的固体。在步骤IV中发生化学反应的离子方程式为___,步骤V中CO2压强越大Na2Cr2O7产率越高,其原因是___。
(5)工业上用电解法制备铬,其装置示意图如图:
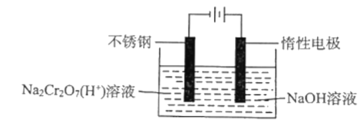
电解池工作时,阴极发生的电极反应式为___,该装置的电能主要转变为___能。
查看答案和解析>>
科目: 来源: 题型:
【题目】次硫酸氢钠甲醛(aNaHSO2bHCHOcH2O)在印染、医药以及原子能工业中应用广泛。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
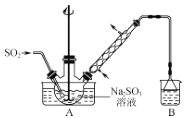
步骤1:在如图所示装置的烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤。
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B的烧杯中应加入的溶液是___。
(2)步骤2中加入锌粉时有NaHSO2和Zn(OH)2生成。
①写出加入锌粉时发生反应的化学方程式:___。
②生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是___。
(3)冷凝管中回流的主要物质除H2O外,还有___(填化学式)。
(4)步骤3中次硫酸氢钠甲醛不在敞口容器中蒸发浓缩的原因是___。
(5)步骤2抽滤所得滤渣的成分为Zn和Zn(OH)2,利用滤渣制备ZnO的实验步骤为:将滤渣置于烧杯中,___,900℃煅烧。(已知:Zn与铝类似,能与NaOH溶液反应;Zn2+开始沉淀的pH为5.9,沉淀完全的pH为8.9,pH>11时,Zn(OH)2能生成ZnO22-。实验中须使用的试剂有1.0molL-1NaOH溶液、1.0molL-1HCl溶液、水)
(6)产物组成测定实验:
准确称取1.5400g样品,溶于水配成l00mL溶液;取25.00mL样品溶液经AHMT分光光度法测得溶液吸光度A=0.4000(如图);另取25.00mL样品溶液,加入过量碘水后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到BaSO4固体0.5825g。

①样品溶液HCHO浓度为___molL-1。
②通过计算确定aNaHSO2·bHCHOcH2O的化学式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com