
科目: 来源: 题型:
【题目】下列说法不正确的是
A.在硫酸工业的吸收塔中,采用浓硫酸吸收三氧化硫
B.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
C.SO2与过量氨水反应得到![]()
D.无水CoCl2吸水会变为蓝色,可用于判断变色硅胶是否吸水
查看答案和解析>>
科目: 来源: 题型:
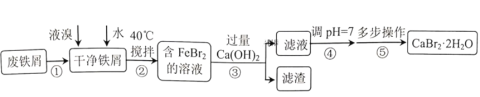
【题目】溴化钙是一种重要的化工原料,常见有![]() 和
和![]() 等结晶形式。某兴趣小组以废铁屑为原料制备
等结晶形式。某兴趣小组以废铁屑为原料制备![]() 的主要流程:
的主要流程:
相关信息如下:
①![]() 吸湿性强。
吸湿性强。
②34℃时结晶得到![]() ,
,![]() 加热至210℃得到
加热至210℃得到![]() 。
。
请回答:
(1)步骤①的目的是去除废铁屑表面的油污,方法是________。
(2)实验室模拟海水提取溴的过程中,用苯萃取溶液中的溴,选出其正确操作并按顺序列出字母:涂凡士林→检漏→()→()→()→()→()→清洗干净。________
a.打开玻璃塞放气
b.打开旋塞放气
c.将溶液和苯转移至分液漏斗中,塞上玻璃塞
d.双手托住分液漏斗,右手压住玻璃塞,左手握住旋塞,上下颠倒振荡
e.右手压住玻璃塞,左手握住旋塞,将分液漏斗倒转振荡
f.置于铁架台铁圈上静置,打开玻璃塞,将旋塞拧开,放出下层液体
g.从下口放出溴的苯溶液
h.从上口倒出溴的苯溶液
(3)步骤④调pH=7,适宜加入的试剂是________,通过调节分液漏斗的活塞可以控制添加液体的速率。当溶液pH接近7时,滴加试剂的分液漏斗的活塞应如图中的________(填序号)所示。

(4)下列有关说法正确的是________。
A.步骤②反应控制在40℃左右,原因是防止反应过于剧烈并减少液溴挥发
B.步骤③滤渣成分只有![]() 、
、![]() 和
和![]()
C.为使![]() 快速结晶,可用冰水浴进行冷却
快速结晶,可用冰水浴进行冷却
D.步骤⑤包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作
(5)制得的![]() 可以通过如下步骤测定其纯度:①称取样品质量;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤,洗涤,干燥;④称量。
可以通过如下步骤测定其纯度:①称取样品质量;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤,洗涤,干燥;④称量。
若实验操作规范而测定结果偏低,其可能的原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期元素的微粒信息如表:
元素代号 | Q | R | X | Z |
微粒信息 | 离子: | 单质分子:R2 | 离子:X3+ | 一种原子: |
已知Q、R、X都在第三周期,R2常温常压下为黄绿色气体。
完成下列填空:
(1)Q在周期表的位置是:___。化合物Q2Z的电子式为___。
(2)Q、R、X的原子半径由大到小的顺序为___(用元素符号表示);Q、R、X、Z中金属性最强的是___(用元素符号表示)。
(3)Q与X两者的最高价氧化物对应的水化物之间发生反应的方程式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氰[(CN)2]的化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间,下列有关反应方程式不正确的是
A. (CN)2和NaOH溶液反应:(CN)2+2OH-=CN-+CNO-+H2O
B. MnO2和HCN反应:MnO2+4HCN(浓)![]() Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
C. 在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2CN-=2Cl-+(CN)2
D. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
查看答案和解析>>
科目: 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售盐酸的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)用酸式滴定管取待测盐酸溶液20.00mL于锥形瓶中,向其中滴加2滴___作指示剂。
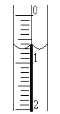
(2)读取盛装0.1000mol/LNaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为____mL。
(3)滴定。当___时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(4)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4mL = 15.24mL。
指出他的计算的不合理之处:___。按正确数据处理,可得c(待测盐酸)=___mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】测定硫酸铜晶体(CuSO4xH2O)中x值的实验过程如下:

完成下列填空:
(1)必须要进行恒重操作的原因是___。
(2)下面是某同学的一次实验记录,请完成下表。
称量数据1 | 称量数据2 | 称量数据3 | 结晶水的X值 | 实验误差 |
11.685g | 13.691g | 12.960g | ____ | ____ |
(3)本次实验测得X值偏__(高、低),可能这次实验中产生误差的原因可能是___。
A.硫酸铜晶体中含有不挥发性杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯、乙炔属于不饱和链烃,易起加成、聚合、氧化反应。
完成下列填空:
(1)乙烯分子中的官能团是____。
(2)能与乙烯发生加成反应的物质是___(填写编号)。
a.溴水 b.氧气 c.氯化氢 d.酸性高锰酸钾溶液
(3)乙烯和氢气的加成产物为____。(写结构简式)
(4)写出乙烯发生加聚反应的化学方程式___。
(5)实验室制取乙炔的化学方程式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A. 1L水中溶解了40.0 g NaOH,该溶液的物质的量浓度为1 mol/L
B. 从1L2mol/L的NaCl液中取出0.5L,取出的该溶液的浓度为1mol/L
C. 中和100 mL 1mol/L的H2SO4溶液,需NaOH8.0g
D. 配制500mL0.5mol/L的CuSO4溶液,需40.0g胆矾
查看答案和解析>>
科目: 来源: 题型:
【题目】过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).

已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___,反应过程中持续通入氮气的目的是___。
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:___。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:___。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
①在___(填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为___。
③若用0.1molL-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为___ g(用含V1的代数式表示,5H2O2~2![]() )。
)。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z三种短周期元素在周期表中的位置如下图所示。若X的最高正价与负价的代数和为2,则下列说法正确是
![]()
A. 原子序数由大到小为 Z >Y>X
B. 氢化物最稳定的元素为Z
C. 最高价氧化物的水化物酸性最强的元素为Z
D. 原子半径由大到小为 Y>Z>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com