
科目: 来源: 题型:
【题目】下列过程都与能量变化有关,其中表述不正确的是( )
A.CO(g)的燃烧热是283.0kJ·mol-1,则表示CO(g)燃烧热的热化学方程式为CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
B.铝热反应会放出大量的热,因此常温下就能顺利发生
C.拆开化学键需要吸收能量,形成化学键会释放能量
D.化学电池是把化学能转化为电能的装置
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作或装置能达到目的的是
A.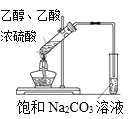 实验室制取乙酸乙酯
实验室制取乙酸乙酯
B.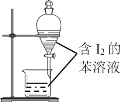 苯萃取碘水中I2,分出水层后的操作
苯萃取碘水中I2,分出水层后的操作
C. 检验CH3CH2Br消去反应的产物乙烯
检验CH3CH2Br消去反应的产物乙烯
D.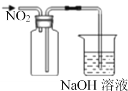 收集NO2气体
收集NO2气体
查看答案和解析>>
科目: 来源: 题型:
【题目】甲硫醇是一种重要的原料和化工试剂,硫化氢与甲醇合成甲硫醇的催化过程如下。下列说法中不正确的是
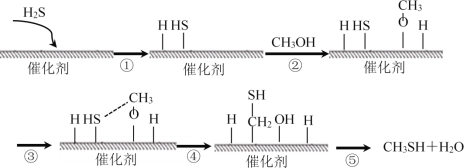
A.CH3SH中碳元素化合价为﹣2价
B.过程⑤中,形成了O—H键和C—H键
C.该催化剂可有效提高反应物的平衡转化率
D.硫化氢与甲醇合成甲硫醇的反应类型为取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】将如图所示实验装置的K闭合,下列判断不正确的是( )
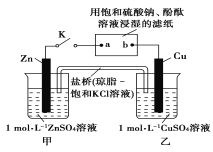
A.Cu电极上发生还原反应
B.片刻后甲池中c(SO42-)不变
C.电子沿Zn→a→b→Cu路径流动
D.片刻后可观察到滤纸a点变红
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铁矿(FeS2)催化氧化的化学方程式为:2FeS2+7O2+2H2O 2FeSO4+2H2SO4。已知NA是阿伏加德罗常数的值,下列说法正确的是
2FeSO4+2H2SO4。已知NA是阿伏加德罗常数的值,下列说法正确的是
A.FeSO4和H2SO4都是离子化合物,均属于强电解质
B.0.1 mol·L-1 FeSO4 溶液中Fe2+离子的浓度为0.1 mol·L-1
C.FeSO4既是被氧化得到的产物,又是被还原得到的产物
D.当转移2 mol电子时,消耗氧气的体积(标准状况)约为22.4 L
查看答案和解析>>
科目: 来源: 题型:
【题目】用14.2g无水硫酸钠配制成500mL溶液,其物质的量浓度为__________molL-1。若从中取出50 mL,其物质的量浓度为__________ molL-1。若将这50 mL溶液用水稀释到100 mL,所得溶液中![]() 的物质的量浓度为__________ molL-1,
的物质的量浓度为__________ molL-1,![]() 的物质的量浓度为__________ molL-1。
的物质的量浓度为__________ molL-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】铅蓄电池是最常见的二次电池,以废旧铅蓄电池中的铅膏(主要含PbO、PbO2、PbSO4等)为原料回收铅,对保护环境和发展循环经济意义重大。某工艺流程如下:
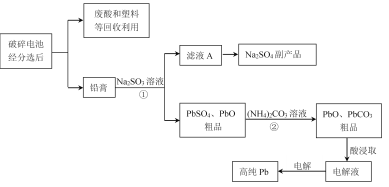
(1)已知铅蓄电池总反应:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,充电时,阳极的电极反应式为________。
2PbSO4+2H2O,充电时,阳极的电极反应式为________。
(2)过程①体现Na2SO3的_________性。
(3)由滤液A可获得Na2SO4·10H2O粗品,检验粗品中SO42-离子的实验方法是________。
(4)结合化学用语解释过程②中PbSO4转化为PbCO3的原因________。
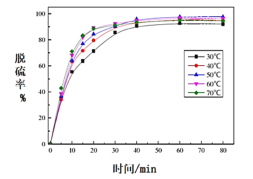
(5)反应温度对过程②转化率(脱硫率)的影响如图所示,实际生产中温度选择在50℃,若温度过高,脱硫率下降的原因可能是:________。
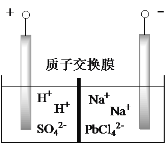
(6)将PbO 、PbCO3粗品置于一定浓度HCl和NaCl浸取液中溶解,得到含Na2PbCl4的电解液,如图电解可得高纯Pb,同时再生浸取液。请结合化学用语解释浸取液再生的原理________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H俗名“氯巴占”,是一种经典的镇静类药物,常用于治疗焦虑症,以下是氯巴占的合成路线:
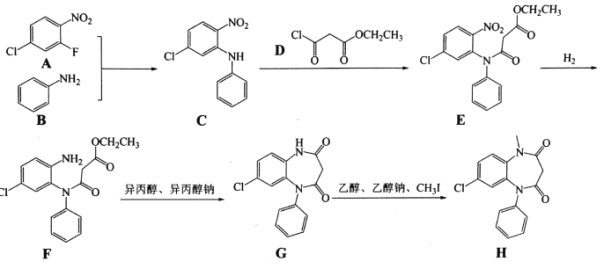
请回答下列问题:
(1)化合物A中含氧官能团的名称为________,化合物B的名称为________。
(2)异丙醇的结构简式为________。
(3)E→F的反应类型为________。
(4)写出F→G的化学反应方程式:________。
(5)化合物D遇水能剧烈水解并生成大量白雾,试写出D与水反应的化学方程式:________。
(6)写出2个符合下列条件的化合物D的同分异构体:________。
i.结构中只含有一个六元环;
ii.核磁共振氢谱中有3组信号峰,且峰面积之比为1:2:4。
(7)由丙二酸可以制备化合物D,请以乙烯为原料制备丙二酸,写出合成路线________(无机试剂任选)。已知碱性条件下:R-Cl+CN-→R-CN+Cl-,R-CN在酸性条件下能水解生成R-COOH。
查看答案和解析>>
科目: 来源: 题型:
【题目】观察下列几个装置示意图,有关叙述不正确的是( )
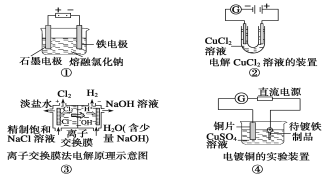
A.装置①工业上可用于生产金属钠,电解过程中石墨电极产生氯气,此法也可用于生产活泼金属镁、铝等
B.装置②中随着电解的进行右边电极会产生红色的铜,并且电流计示数不断变小
C.装置③中的离子交换膜具有很强的选择性,只允许某类离子(如Na+)通过
D.装置④的待镀铁制品应与电源负极相连
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸铈[Ce2(CO3)3]是制备稀土发光材料、汽车尾气净化催化剂的重要原料。碳酸铈可由铈的氯化物和碳酸氢铵反应制备。甲同学利用下列装置模拟制备Ce2(CO3)3:
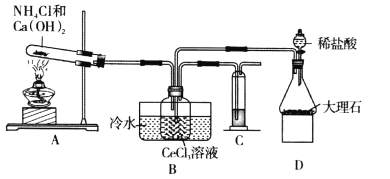
已知:i.装置C中溶液为亚硫酸钠溶液;
ii.Ksp[Ce2(CO3)3]=1.00×10-28;
iii.Ce3+易被空气氧化成Ce4+。
(1)装置D中盛放稀盐酸的实验仪器名称为________,装置C中溶液的作用是________。
(2)装置A中发生的化学反应方程式为________。
(3)实验装置中有一处不合理,请针对不合理之处写出改进措施:________。
(4)装置B中制备Ce2(CO3)3反应的离子方程式为________。
(5)实验过程中当Ce3+沉淀完全时![]() ,溶液中
,溶液中![]() 为________。
为________。
(6)Ce2(CO3)3在装置B中沉淀,然后经过静置、过滤、洗涤、干燥后即可得到产品。检验产品是否洗涤干净的方法为________。
(7)为测定产品中Ce2(CO3)3的纯度,取![]() 产品加入稀硫酸、
产品加入稀硫酸、![]() 溶液至全部溶解,配成
溶液至全部溶解,配成![]() 溶液,取
溶液,取![]() 溶液用
溶液用![]() 的
的![]() 溶液滴定至终点(铈被还原成Ce3+),消耗
溶液滴定至终点(铈被还原成Ce3+),消耗![]() 溶液
溶液![]() ,则产品中Ce2(CO3)3的纯度为________。
,则产品中Ce2(CO3)3的纯度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com