
科目: 来源: 题型:
【题目】在一密闭容器中,反应mA(g)![]() nB(g)+pC(s)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
nB(g)+pC(s)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.m<n+pB.物质A的转化率减小
C.物质B的质量分数减小D.平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中进行如下反应: X2(g)+Y 2(g) ![]() 2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z 为 0.3mol/LB.Y2 为 0.4mol/LC.X2 为 0.2mol/LD.Z 为 0.4mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钙晶体(CaO2·8H2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
(1)过氧化钙晶体可用下列方法制备:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用如下制取装置制备过氧化钙晶体。
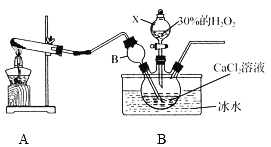
①装置A中发生反应的化学方程式为____________。
②装置C采用冰水浴控制温度在0 ℃左右,可能的原因主要有:
Ⅰ. 该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
Ⅱ.__________________________________。
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验晶体已洗涤干净的操作为:______。
(2)测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入2 mol·L-1的硫酸溶液,充分反应(I-被氧化I2)。
步骤二:向上述锥形瓶中加入几滴淀粉溶液以指示反应的终点。
步骤三:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出3次平均消耗Na2S2O3溶液体积为V mL。发生的反应为:I2+2S2O32-=2I-+S4O62-,产品中CaO2·8H2O的质量分数为____(用含字母的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行相关实验。
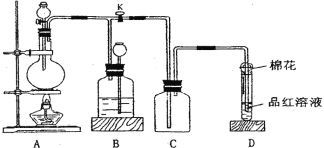
请回答:
(1)装置 A 中发生的化学反应方程式为________________________。
(2)装置 D 中试管口放置的棉花中可以浸上NaOH溶液, 其作用是_____________。
(3)装置 B 的作用是贮存多余的气体。当 D 处有明显的现象后,关闭旋塞 K 并移去酒精灯。B 中应放置的液体是(填字母) ____。
a.水 b.酸性 KMnO4 溶液 c.饱和 NaHSO3 溶液 d.浓溴水
(4)实验中,取一定质量的铜片和一定体积 18 mol·L—1 的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。有一定量的余酸但未能使铜片完全溶解,你认为可能的原因是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列叙述正确的是
①增加A的量,平衡向逆反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】镍(Ni)有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面有广泛的应用。以硫化镍矿(主要成分为NiS,另含少量CuS,FeS等杂质)为原料制取纯镍的工艺流程如下:
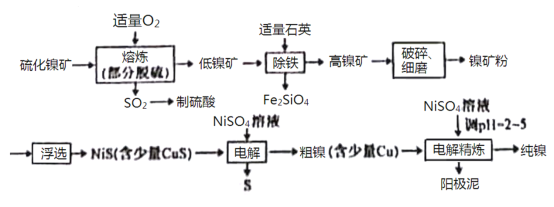
已知物质的还原性:Fe>Ni>H2>Cu。
回答下列问题:
(1)在“熔炼”过程中,二价铁的化合价没有发生改变,则杂质FeS与O2反应的化学方程式为___________________。
(2)高镍矿破碎、细磨的作用是___________________。
(3)在焰色反应实验中,可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是___________________。
(4)“除铁”过程中,反应的化学反应方程式为___________________。
(5)“电解”制粗镍过程中,阳极发生的主要电极反应为___________________。
(6)“电解精炼”过程中,需调节溶液的pH为2~5,原因是___________________。阳极泥的成分为___________________(写名称)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A是一种重要的化工原料,用A制取新型聚合物F的合成路线如下:
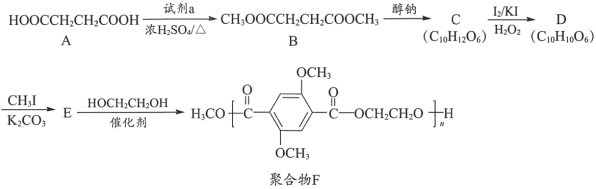
已知:i. 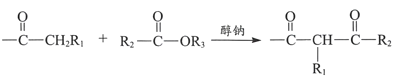 +R3OH
+R3OH
ii. 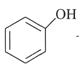 +R1I
+R1I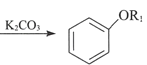 +HI
+HI
iii.R1COOR2+R3OH![]() R1COOR3+R2OH
R1COOR3+R2OH
(1)A中官能团的名称为____________。
(2)试剂a为____________。
(3)C中含有一个六元环,C的结构简式为____________。
(4)C→D的反应类型为______。
(5)E→F的化学方程式是__________________。
(6)下列说法正确的是____________(填序号)。
a. A能与NaHCO3溶液反应
b. 醇钠可由醇与金属钠反应制得
c. 可用FeCl3溶液鉴别D和E
d. HOCH2CH2OH俗称甘油
(7)以乙醇为起始原料,利用已知信息、选择必要的无机试剂合成CH3COCH2COOC2H5写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com