
科目: 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是( )
A.化学反应中电子转移的表示方法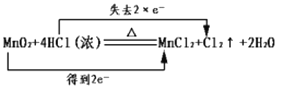
B.离子M2O7x-与S2-能在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+=2M3+ +3S +7H2O,则M2O7x-中M的化合价为+7
C.在常温下发生以下几个反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O②2A2++B2=2A3++2B-③2B-+Z2 =B2+2Z-根据上述反应,可知道氧化性强弱顺序为:XO4->Z2>B2>A3+
D.已知硝酸铵在一定温度下分解为5NH4NO3=4N2↑+2HNO3+9H2O↑,被氧化的元素和被还原的元素的质量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中。回答下列问题:
(1)基态碳原子核外有________种能量不同的电子, 其核外电子运动状态由_____ 种因素决定。
(2)CH4分子间不能形成氢键, 主要原因是CH4 分子中的碳原子不含孤对电子、_____ 、 _____________。
(3)碳酸的非羟基氧的个数和磷酸的非羟基氧的个数都是1, 从结构上分析,它们的强度 相近,均为中强酸。然而事实上二氧化碳水溶液的酸性却很弱,原因是__________。
(4)乙二胺(H2NCH2CH2NH2)是 一种有机化合物, N 原子的杂化轨道类型为______,乙二胺通过配位键能与Cu2+ 形成稳定的环状配离子,其结构可表示为__________。
(5)金刚石是碳的一种同素异形体,属于_______ 晶体。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A 所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是下图 ___________(从 A~D 图中选填).
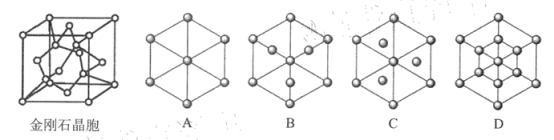
若碳原子半径为r ,金刚石晶胞中碳原子的空间占有率为_____________( 用含π 的代数.式表示).
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能源是公认的零碳消洁能源,用乙醇为原料可通过多种方法制氢,具有理想的应用前景。回答下列问题:
(一)乙醇催化重整制氢
原理:C2H5OH(g)+3H2O(g)![]() 2CO2(g)+6H2(g)△H1
2CO2(g)+6H2(g)△H1
以Ni/凹凸棒石做催化剂,在2L刚性容器中,分别以水醇比为2:1、4:1、6:1、8:1投料(乙醇的起始物质的量相同),反应相同时间测得乙醇转化率随温度变化的关系如图所示。
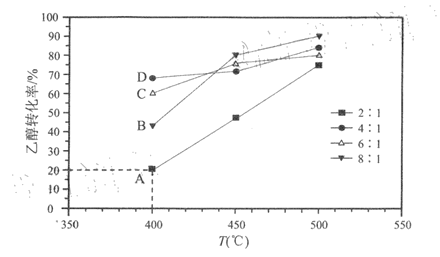
已知:过多的水分子会占据催化剂表面活性位,导致反应速率降低:上图中水醇比为2:1时,各点均已达到平衡状态。
(1)反应热△H1________0(填“>”或“<”)。若乙醇的起始物质的量为n0mol,则K(400℃)=______________(列出计算式)。
(2)400℃时,水醇比过高不利于乙醇转化的原因是____________________________;B、C、D三点中,一定未达到平衡状态的是______________(填标号)。
(二)乙醇氧化制氢
原理:C2H5OH(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+3H2(g) △H2
2CO2(g)+3H2(g) △H2
(3)已知H2(g)+![]() O2(g)
O2(g)![]() H2O(g) △H3,则△H2=_____(用含△H1和△H3的式子表示)。在密闭容器中通入一定量的乙醇和氧气,达到平衡状态后增大容器体积,则混合气体的平均相对分子质量将_________(填“增大”“减小”或“不变”)。
H2O(g) △H3,则△H2=_____(用含△H1和△H3的式子表示)。在密闭容器中通入一定量的乙醇和氧气,达到平衡状态后增大容器体积,则混合气体的平均相对分子质量将_________(填“增大”“减小”或“不变”)。
(三)乙醇电解法制氢
乙醇电解法不仅可以利用乙醇本身的氢,还可以从水中获得氢,且电解乙醇所需电压比电解水的理论电压要低很多。
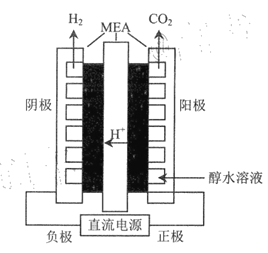
(4)利用如图所示装过(MEA为复杂的膜电极)电解乙醇制氢,阳极的电极反式应为___________,理论上每转移lmol电子,可以产生________L氢气(标准状况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是( )
A.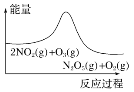 平衡后降温,NO2含量降低
平衡后降温,NO2含量降低
B.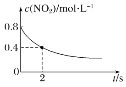 0~2 s内,υ(O3)=0.2 mol·L-1·s-1
0~2 s内,υ(O3)=0.2 mol·L-1·s-1
C.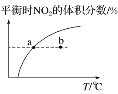 υ正:b点<a点,b点:υ逆<υ正
υ正:b点<a点,b点:υ逆<υ正
D.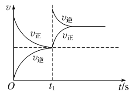 恒温,t1时再充入O3
恒温,t1时再充入O3
查看答案和解析>>
科目: 来源: 题型:
【题目】银铜合金广泛应用于航空工业。从银铜合金的切割废料中回收银和制备CuAlO2的流程
如下。
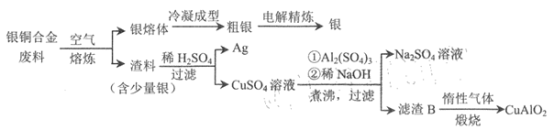
已知:Al(OH) 3和Cu(OH) 2开始分解的温度分别为450℃和 80℃。 下列说法错误的是
A.电解精炼时,粗银做阳极,纯银做阴极
B.为提高原料利用率,流程中应加过量的稀NaOH
C.滤渣B煅烧时发生的反应为 4CuO+4Al(OH)3![]() 4CuA1O2+ O2↑+6H2O
4CuA1O2+ O2↑+6H2O
D.若用 1.0 kg 银铜合金(铜的质量分数为64%) 最多可生成 10.0mol CuA1O2
查看答案和解析>>
科目: 来源: 题型:
【题目】LiFePO4电池具有能量密度大、绿色环保等优点,在可再生能源发电站发电安全并网等领域有着良好的应用前景。LiFePO4 电池结构如图所示,电池反应为:Li1-xFePO4+ LixC6 ![]() C6+ LiFePO4。
C6+ LiFePO4。

下列说法错误的是
A.充电时, Li+通过聚合物隔膜由左向右移动
B.充电时, 阳极反应为LiFePO4 -xe-=Li1-xFePO4+ xLi+
C.放电时, 负极反应为LixC6 -xe-= xLi++ C6
D.放电时,电子由左侧电极通过外电路移向右侧电极
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,将 2mol NO2 装入 5 L 带活塞的密闭容器中,当反应 2NO2(g) N2O4(g)ΔH=-60 kJ/mol 达到平衡时,恢复到原来的温度,测得此过程中体系向外界共释放了 40 kJ 的热量。 下列说法正确的是( )
A.温度升高,平衡常数 K 增大
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.上述反应达到平衡时,NO2的转化率是 40%
D.若起始时向容器中充入 1.0 mol N2O4,保持温度不变,达到平衡时共吸收 20 kJ的热量
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA 为阿伏伽德罗常数的值。已知常温下 1L0.1molL-1NaHSO3溶液的pH=4,该溶液中存在如下平衡:①HSO3-![]() H++SO32- ② HSO3- + H2O
H++SO32- ② HSO3- + H2O![]() H2SO3+ OH-。下列说法正确的是
H2SO3+ OH-。下列说法正确的是
A.将该溶液加热蒸干、灼烧可得NaHSO3固体
B.加水稀释该溶液,平衡①正向移动,溶液中c(H+ )增大
C.该溶液中c(OH-)+ c(SO32-)=c(H+) +c(H2SO3)
D.该溶液中阴阳离子总数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】红钠矾(重铬酸钠: Na2Cr2O72H2O )是重要的基础化工原料,易溶于水,有强氧化性 ,极毒。2012 年中国科学院研究所发明了以铬酸钡为中间体,由铭酸钾制备高纯度重铬酸钠的方法。该方法的转化条件温和,污染物排放少,流程如下所示。
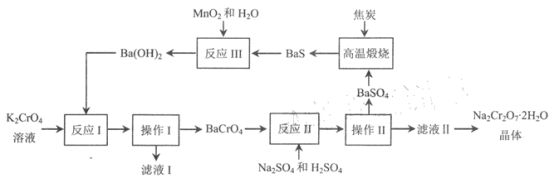
回答下列问题:
(1)操作I和操作II的名称均是 ____________, 滤液 I中溶质的主要成分的化学式为_____________。
(2)反应I、II、III中属于氧化还原反应的是____________________。
(3)高温煅烧时需加入过量焦炭,发生反应的化学方程式为 ________________.
(4)从平衡角度分析,反应 II 加H2SO4调节 pH 的原因是_______________(用离子方程式表示); 反应 II 不能用 HCl 替代H2SO4 的原因是_________________。
(5)含Cr2O72- 的废水需经化学处理,使其浓度降至符合国家有关标准方可排放。通常可在酸性废水中先加入适量绿矾(FeSO47H2O ) ,将Cr2O72- 还原成Cr3+,发生反应的离子方程式为___________, 再加入过量的石灰水,使 Cr3+转变为Cr(OH)3沉淀。用该方法处理 c(Cr2O72-) =1.5×10-3 mol·L-1的废水 10 m3,至少需要绿矾______kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知甲为恒温、恒压容器,乙为恒温、恒容容器。两容器中均充入1 mol N2、3 mol H2,初始时两容器的温度、体积相同。一段时间后反应达到平衡,为使两容器中的N2在平衡混合物中的物质的量分数相同,下列措施中可行的是 ( )
A.向甲容器中充入一定量的氦气
B.向乙容器中充入一定量的N2
C.升高乙容器的温度
D.增大甲容器的压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com