
科目: 来源: 题型:
【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。沉淀渣中除含有铜![]() 、硒
、硒![]() 、碲
、碲![]() 外,还含有少量稀贵金属,主要物质为
外,还含有少量稀贵金属,主要物质为![]() 、
、![]() 和
和![]() 。
。
(1)![]() 、
、![]() 、
、![]() 为同主族元素,其中
为同主族元素,其中![]() 在元素周期表中的位置____。
在元素周期表中的位置____。
其中铜、硒、碲的主要回收流程如图:

(2)经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。
①写出![]() 硫酸化焙烧的化学方程式____。
硫酸化焙烧的化学方程式____。
②“水浸固体”过程中补充少量氯化钠固体,可减少固体中的银(硫酸银)进入浸出液中,结合化学用语,从平衡移动原理角度解释其原因___。
③滤液2经过____、_____、过滤、洗涤、干燥可以得到硫酸铜晶体。
(3)所得粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示。蒸馏操作中控制的最佳温度是____(填序号)。

a.455℃ b.462℃ c.475℃ d.515℃
(4)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着![]() 浓度的增加,促进了
浓度的增加,促进了![]() 的沉积。写出
的沉积。写出![]() 的沉积的电极反应式为____。
的沉积的电极反应式为____。

查看答案和解析>>
科目: 来源: 题型:
【题目】有机物G是合成新农药的重要中间体。以化合物A为原料合成化合物G的工艺流程如下:

(1)化合物G中含氧官能团的名称为________。
(2)反应D→E的反应类型为________。
(3)化合物B的分子式为C7H6Cl2,B的结构简式为______。
(4)写出同时满足下列条件的G的一种同分异构体的结构简式:______。
①能发生银镜反应;
②核磁共振氢谱显示氢原子的峰值比为3∶2∶2∶1。
(5)请以化合物F和CH2(COOC2H5)2为原料制备 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】锰元素的化合物在多个领域中均有重要应用。
(1)二价锰的3种离子化合物的熔点如表:
物质 | MnCl2 | MnS | MnO |
熔点 | 650℃ | 1610℃ | 2800℃ |
上表3种物质中晶格能最大的是___。
(2)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为___。
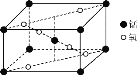
(3)与NO3-互为等电子体的一种分子为___(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可利用SO2与Cl2在活性炭的催化下制取一种重要的有机合成试剂磺酰氯(SO2Cl2)。所用的反应装置如图所示(部分夹持装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,遇潮湿空气会产生白雾。
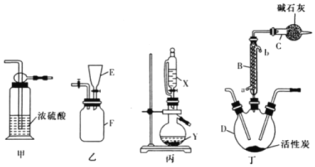
(1)化合物SO2Cl2中S元素的化合价为__。
(2)仪器D的名称是___。
(3)乙、丙装置制取原料气Cl2与SO2。
①乙装置F中充满Cl2,则E中所盛放的溶液为___(填溶液的名称)。
②丙装置中试剂X、Y的组合最好是__。
A.98%浓硫酸+Cu B.70%H2SO4+Na2SO3 C.浓HNO3+Na2SO3
(4)上述装置的正确连接顺序为__、__、丁、__、__(用甲、乙、丙表示,可重复使用)__。
(5)B装置中从a口通入冷水的作用是__;C装置的作用是__。
(6)SO2Cl2遇水能发生剧烈的水解反应,会产生白雾,则SO2Cl2发生水解反应的化学方程式为__。
(7)若反应中消耗氯气的体积为1.12L(已转化为标准状况,SO2足量),最后通过蒸馏得到纯净的磺酰氯5.13g,则磺酰氯的产率为__(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关钠的化合物说法正确的是( )
A. 将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
B. 用加热法除去NaHCO3固体中混有的Na2CO3
C. 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,一定没有K+
D. Na2O2可用于呼吸面具中氧气的来源
查看答案和解析>>
科目: 来源: 题型:
【题目】肼(N2H4)主要用作火箭和喷气发动机燃料。
(1) 已知 ① 2O2(g)+N2(g) === N2O4(l) ΔH=a kJ·mol-1
② N2(g)+2H2(g) === N2H4(l) ΔH=b kJ·mol-1
③ 2H2(g) + O2(g) = 2H2O(g) ΔH=c kJ·mol-1
某型号火箭采用液态肼和液态N2O4作推进剂,燃烧生成两种无污染的气体。写出反应的热化学方程式____。偏二甲肼(1,1-二甲基肼)也是一种高能燃料,写出其结构简式______。
(2)肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的化学方程式________,理论上,每消耗64 g肼可除去标准状况下O2________L
(3)科学家用肼作为燃料电池的燃料,电池结构如图1所示,

写出电池负极的电极反应式:________。
(4)N2H4在特定条件下(303K,Pt,Ni作催化剂)可以发生部分分解:N2H4(g) ![]() 2H2(g)+N2(g),在2 L的密闭容器中加入0.1 mol N2H4(g),测得0-4分钟内N2的物质的量随时间的变化曲线如图2所示,写出0-2分钟内H2的平均反应速率v(H2)=________。
2H2(g)+N2(g),在2 L的密闭容器中加入0.1 mol N2H4(g),测得0-4分钟内N2的物质的量随时间的变化曲线如图2所示,写出0-2分钟内H2的平均反应速率v(H2)=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是有关钠与水反应及产物检验的实验装置。实验开始时先向管内加入滴有酚酞试液的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中。回答下列问题:
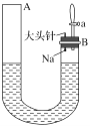
(1)钠与水反应的化学方程式为_____________。
(2)钠与水反应的现象有很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是_________。
②能证明钠的熔点低的现象是_________。
③能证明有氢氧化钠生成的现象是__________。
④能证明有气体产生的现象是A端液面________(填“上升”“下降”或“不变”,下同),B端液面________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据图填空。
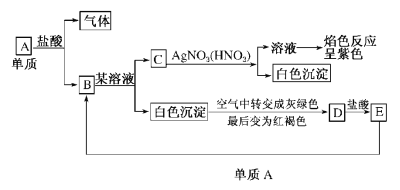
(1)写出下列各物质的化学式:
A__________,B__________,C__________,
D__________,E__________。
(2)写出生成D的反应方程式_____________________________。
(3)写出E→B的离子方程式______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是_______、_______。
(2)取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是_______。
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过_______mL。
(4)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到_______克固体。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取气体装置一般由发生装置、净化装置、收集装置以及尾气吸收装置组成。以Cl2的实验室制法为例(见下图):
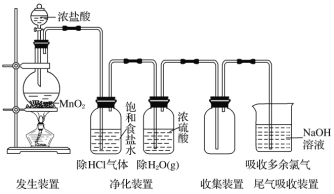
(1)反应原理:用强氧化剂(如KMnO4、K2Cr2O7、KClO3、MnO2等)氧化浓盐酸。MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)制备装置类型:固体+液体![]() 气体
气体
(3)净化方法:用___________________除去HCl,再用浓硫酸除去水蒸气。
(4)收集方法:________________法或排饱和食盐水法。
(5)尾气吸收:用强碱溶液(如NaOH溶液)吸收,不用Ca(OH)2溶液吸收的原因是_________________________________________________________________________。
(6)验满方法:将湿润的淀粉-KI试纸靠近盛Cl2的试剂瓶口,观察到__________________,则证明已集满;或将湿润的_________________靠近盛Cl2的试剂瓶口,观察到试纸先变红后褪色,则证明已集满。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com