
科目: 来源: 题型:
【题目】食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知:CH3COOH、H2CO3、HNO2的电离常数(25℃)分别为Ka=1.8×10-5;Ka1=4.3×10-7、Ka2=5.6×10-11;Ka=5.0×10-4请回答下列问题:
⑴一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____(填代号。)
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)·c(H+)不变
⑵25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中:
c(CH3COO-)/c(CH3COOH)=____
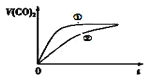
⑶常温下,将20mL 0.1mol/L CH3COOH溶液 和20mL 0.1mol/LHNO2 溶液分别与 20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示,则表示CH3COOH溶液的曲线是_______(填写序号);
⑷体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示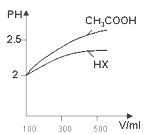 ,则HX的电离平衡常数______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
,则HX的电离平衡常数______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
⑸25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb =___________
查看答案和解析>>
科目: 来源: 题型:
【题目】1,3 - 环己二酮( )常用作医药中间体,用于有机合成。下列是一种合成1,3-环己二酮的路线。
)常用作医药中间体,用于有机合成。下列是一种合成1,3-环己二酮的路线。
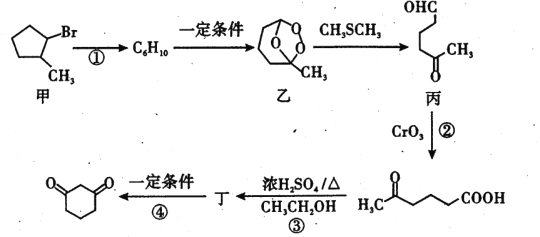
回答下列问题:
(1)甲的分子式为 ___________________。
(2)丙中含有官能团的名称是______________________ 。
(3)反应①的反应类型是 _________ ;反应②的反应类型是 ______________。
(4)反应③的化学方程式为_________________________________。
(5)符合下列条件的乙的同分异构体共有_____________种。
①能发生银镜反应
②能与NaHCO3溶液反应,且 1 mol 乙与足量NaHCO3 溶液反应时产生气体22. 4 L( 标准状况)写出其中在核磁共振氢谱中峰面积之比为 1 : 6 : 2 : 1 的一种同分异构体的结构简式 __________________。(任意一种)
(6)设计以乙醇、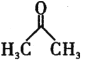 (丙酮)为原料制备
(丙酮)为原料制备![]() (2,4 -戊二酮)的合成路线________________(无机试任选)。
(2,4 -戊二酮)的合成路线________________(无机试任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
(1)取冰醋酸配制250mL 0.4 mol·L-1的醋酸溶液,用0.4mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
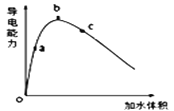
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。则稀释过程中溶液的pH由大到小的顺序____(填字母)。
②为标定该醋酸溶液的准确浓度,用0.2000mol·L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
该醋酸溶液的准确浓度为_____________(保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是_____________(多选、错选不得分)。
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
(2)该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度( mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
①根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是___________。
②简述用pH试纸测 0.1mol·L-1 醋酸溶液pH的方法___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯( NOCl) 是有机合成中的重要试剂,为黄色气体或红褐色液体(熔点- 64. 5℃,沸点-5.5℃),具有刺鼻恶臭味,遇水和潮气水解,有多种方法制备。
(1)方法一:将5 g 经300℃下干燥了 3h 并研细的 KCl 粉末装入 50 mL 带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压下通入0. 002 mol NO2。反应 12 ~ 36 min 即可完成,NO2红棕色消失 ,出现黄色亚硝酰氯,同时还得到一种盐。写出亚硝酰氯的电子式________,该方法制备NOCl的化学方程式为_________________,氯化钾需要“干燥”的原因是_______________。
(2)方法二:实验室可用如图装置制备亚硝酰氯(NOCl),检验装置气密性并装入药品打开 K2,然后再打开___________(填“K1 ”或"“K3 ”) 通入一段时间气体,其目的为______,然后进行其他操作,当 Z 有一定量液体生成时,停止实验。写出X 装置中反应的离子方程式_____________________ 。

(3)测定产品纯度:取(2)中w g Z 中液态产品溶于蒸馏水,配制成250 ml 溶液;用酸式滴定管准确量取25. 00mL 所配溶液于锥形瓶中,滴加几滴 K2CrO4溶液作指示剂,用滴定管盛装 c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液体积为V mL。[已知:Ksp( AgCl ) =1.56 ×10-10 ,Ksp(Ag2CrO4)=1×10-12,Ag2CrO4为砖红色固体,忽略杂质参与反应]
①盛装AgNO3 标准溶液的滴定管是____(填“酸式”或“碱式”)棕色滴定管;判断达到滴定终点的方法是_____________________。
②该产品纯度为_____________(用代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,回答下列问题:
(1)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g) = SiH2Cl2(g) + SiCl4(g) △H1 = +48kJ/mol
4SiHCl3(g) = SiH4(g) + 3SiCl4(g) △H3 = +114kJ/mol
则反应3SiH2Cl2(g) = SiH4(g) + 2SiHCl3(g)的△H=______________kJ/mol。
(2)对于反应2SiHCl3(g) = SiH2Cl2(g) + SiCl4(g),采用合适的催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。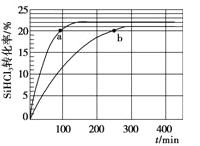
①比较a、b处反应速率大小:υa_____υb(填“>”、“<”、“=”)
②在343 K下:要缩短反应达到平衡的时间,可采取的措施有____。
A、增大反应物浓度
B、增大压强
C、及时将产物从体系分离
D、使用更高效的催化剂
③某温度(T K)下,该反应可使SiHCl3的平衡转化率达到30%,则该温度下的平衡常数KT K___K343 K(填“>”、“<”、“=”),已知反应速率υ=υ正-υ逆=k正x2(SiHCl3)-k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在该温度下当转化率为20%的时刻,υ正/υ逆=________(保留1位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将2mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将2mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
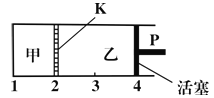
A.升高温度,达到新平衡后,甲中B的体积分数增大,乙中B的体积分数减小
B.将活塞由“4”推进到“3”,达到新平衡后,甲、乙两容器中C的百分含量相同
C.保持温度不变,向甲中再加入1mol A和2mol B,达到新平衡后,c(B)甲>2c(B)乙
D.保持温度和乙中压强不变,向乙中再加入2mol D,达到新平衡后,c(B)乙≤2c(B)甲
查看答案和解析>>
科目: 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
A | B | C | D |
|
|
|
|
升高温度,正反应方向平衡常数减小 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断不正确的是
A. 生成44.8L N2(标准状况)
B. 有0.25 mol KNO3被还原
C. 转移电子的物质的量为1.75mol
D. 被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关滴定的说法正确的是( )
A. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
B. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中有NaOH杂质,则结果偏低
C. 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高猛酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为![]() mol/L
mol/L
D. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com