
科目: 来源: 题型:
【题目】有机化合物E(![]() )是工业上合成一种锅炉防腐剂的中间体,合成路线如下:
)是工业上合成一种锅炉防腐剂的中间体,合成路线如下:
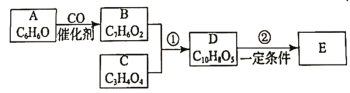
已知:
①R1CHO+R2CH2COOH![]() R1CH=C(R2)COOH+H2O(R1、R2为烃基或其它有机原子团)
R1CH=C(R2)COOH+H2O(R1、R2为烃基或其它有机原子团)
②RCH=C(COOH)2![]() RCH=CHCOOH+CO2
RCH=CHCOOH+CO2
③CH3CH=CH2+Cl2![]() ClCH2CH=CH2+HCl
ClCH2CH=CH2+HCl
回答下列问题:
(1)有机物A的名称为________。1 mol有机物C与足量![]() 反应,能产生标准状下44.8 L
反应,能产生标准状下44.8 L ![]() ,写出C的结构简式:__________。
,写出C的结构简式:__________。
(2)有机物B中含有的官能团的名称为____________。比B多一个“![]() ”原子团的同系物M,满足下列条件的同分异构体有__________种,其中核磁共振氢谱为5组峰的结构简式为____________。①与氯化铁溶液混合成紫色;②能发生银镜反应
”原子团的同系物M,满足下列条件的同分异构体有__________种,其中核磁共振氢谱为5组峰的结构简式为____________。①与氯化铁溶液混合成紫色;②能发生银镜反应
(3)有机物D能发生的化学反应有_________(填写选项字母)。
A.加成反应 B.水解反应 C.氧化反应 D.消去反应
(4)写出反应①的化学方程式:__________________________
(5)根据题目信息,以丙烯为原料(其他无机试剂任选),设计制备化合物C的合成路线:______________
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸工业尾气中的氮氧化合物NOx(NO、NO2、N2O4)常用的处理方法有以下两种:
①碱液(Na2CO3或NaOH溶液)吸收法。用Na2CO3溶液吸收反应原理如下:
NO + NO2 + Na2CO3 == 2NaNO2 + CO2;2NO2 + Na2CO3 == NaNO2 + NaNO3 + CO2
②氨的催化氧化法,反应原理是:NOx + NH3![]() N2 + H2O
N2 + H2O
现将标准状况下2.016 L氮氧化合物NOx 通入50 mL 1.0 mol·L-1的Na2CO3溶液,恰好反应完全,且测得反应后溶液中n(NO2-)∶n(NO3-) = 4∶1,下列说法正确的是
A. 混合气体中V(N2O4) = 0.336 L
B. 混合气体中n(NO)∶n(NO2) = 1∶5
C. NOx能够完全被Na2CO3溶液吸收,则x ≤ 1.5
D. 如采用氨的催化氧化法处理,理论消耗n(NH3) = ![]() mol
mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO+4NH+2H2O
B.Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.水玻璃中通入少量的二氧化碳:Na2SiO3+CO2+H2O=2Na++CO32-+H2SiO3↓
D.少量SO2通入漂白粉溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.在标准状况下,1 mol SO3体积等于22.4 L
B.标准状况下,7.1 g氯气与足量氢氧化钠稀溶液反应转移的电子数为0.1NA
C.1 mol Fe(OH)3胶体中含有的胶粒数目为NA
D.2 L 0.5 mol·L1硫酸钾溶液中阴离子所带电荷数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铜溶液可用于浸取硫铁矿中的铁,浸取时发生复杂的氧化还原反应,反应体系中除![]() 和
和![]() 外,还有
外,还有![]() 、
、![]() 、
、![]() 和
和![]() ,下列对该反应的分析不正确的是( )
,下列对该反应的分析不正确的是( )
A.氧化剂为![]() 和
和![]()
B.反应后溶液的pH降低
C.每转移2 mol电子消耗3 mol ![]()
D.被氧化的![]() 只占总量的30%
只占总量的30%
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某温度(T℃)时,水的Kw=1×10-12,则该温度___(填“>”、“<”或“=”)25℃,其理由是___。
(2)该温度下,c(H+)=1×10-7mol·L-1的溶液呈___(填“酸性”、“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=____mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述不正确的是
A.在标准状况下,将22.4 L氨气溶于1 L水中,得到1 mol·L-1的氨水
B.配制0.1 mol·L-1的Na2CO3溶液480 mL,需用500 mL容量瓶
C.10 mL质量分数为98%的H2SO4溶液,用10 mL水稀释后,H2SO4的质量分数大于49%
D.向两等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1∶1(保持温度不变)
查看答案和解析>>
科目: 来源: 题型:
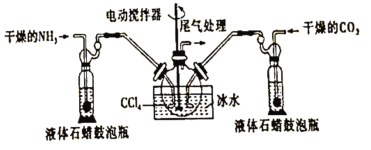
【题目】氨基甲酸铵(![]() )是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下仪器模拟制备氨基甲酸铵,已知该制备反应为放热反应。制备氨基甲酸铵的装置如图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
(1)制备氨基甲酸铵的化学方程式为____________
(2)三颈烧瓶用冰水冷却的原因是______________
(3)液体石蜡鼓泡瓶的作用是_______________
(4)水是很好的溶剂,且可以大量吸收反应混合气体,该反应中是否可用水作溶剂:________(填“是”或“否”),理由:___________
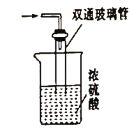
(5)尾气处理装置如图所示,双通玻璃管的作用是_________,浓硫酸的作用是________
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得其质量为1.00 g。则样品中氨基甲酸铵的质量分数为________
查看答案和解析>>
科目: 来源: 题型:
【题目】在水的电离平衡中,c(H+)和c(OH)的关系如图所示:
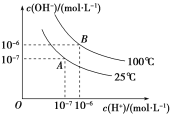
(1)A点水的离子积常数为1×1014,B点水的离子积常数为________________。造成水的离子积常数变化的原因是________________________________________________________________________。
(2)100 ℃时,若向水中滴加盐酸,________(填“能”或“不能”)使体系处于B点状态,原因是____________________________________________________________________。
(3)100 ℃时,若盐酸中c(H+)=5×104 mol·L1,则由水电离产生的c(H+)=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铅是一种高密度、柔软的蓝灰色金属。2019年7月23日,铅被列入有害水污染物名录。请回答下列问题。
(1)Pb位于第六周期,与C元素同族。请写出它的外围电子排布式___________,对比以下三种氧化物的熔沸点![]() 、
、![]() 、
、![]() ,从小到大分别为_____________,请解释原因:____________________。
,从小到大分别为_____________,请解释原因:____________________。
(2)铅在自然界主要以方铅矿(PbS)及白铅矿(![]() )的形式存在,也存在于铅矾(
)的形式存在,也存在于铅矾(![]() )中。
)中。![]() 中心原子轨道的杂化类型___________,
中心原子轨道的杂化类型___________,![]() 的空间构型____________。
的空间构型____________。
(3)四乙基铅[![]() ]曾广泛用作汽油中的抗爆剂,由Pb提供空轨道,有机原子团提供孤电子对形成,该化合物中存在化学键类型有_____________
]曾广泛用作汽油中的抗爆剂,由Pb提供空轨道,有机原子团提供孤电子对形成,该化合物中存在化学键类型有_____________
A.金属键 B.离子键 C.共价键 D.配位键
(4)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(![]() )半导体作为吸光材料,
)半导体作为吸光材料,![]() 具有钙钛矿(
具有钙钛矿(![]() )的立方结构,其晶胞如图所示:
)的立方结构,其晶胞如图所示:
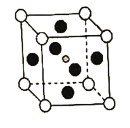
①比较元素电负性:C_________N(填“>”或“<”),比较基态原子第一电离能:C________Pb(填“>”或“<”)
②![]() 晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M在晶胞中处于_____________位置,X在晶胞中处于________位置。
晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M在晶胞中处于_____________位置,X在晶胞中处于________位置。
③![]() 晶体的晶胞边长为a nm,其晶体密度为d
晶体的晶胞边长为a nm,其晶体密度为d![]() ,则阿伏加德罗常数的值NA的计算表达式为_____________
,则阿伏加德罗常数的值NA的计算表达式为_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com