
科目: 来源: 题型:
【题目】向10 mL某浓度的AlCl3溶液中滴加1.5 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
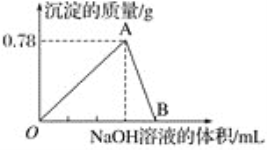
(1)图中B点溶液中的溶质有________________。
(2)O点到B点反应的总离子方程式可表示为________________。
(3)反应至A点时消耗NaOH溶液的体积为______________。
(4)AlCl3溶液的浓度为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究二氧化硫的性质,按如图所示装置进行实验。
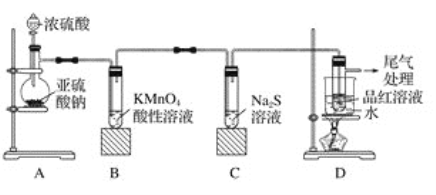
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是__________,反应的化学方程式为_______________。
(2)装置B中的现象是__________________,反应的离子方程式为_________________。
(3)装置C中的现象是______________,该现象说明二氧化硫具有的性质是_____________。
(4)装置D的目的是探究二氧化硫与品红作用的可逆性,写出实验操作及现象_____________。
(5)尾气吸收发生反应的离子方程式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘化钠在光学器件石油探测、安检、环境监测等领域有重要应用。某研究小组开发设计的制备高纯NaI的简化流程如图:

已知:
①I2(s)+I-(aq)![]() I3-(aq)。
I3-(aq)。
②水合肼(N2H4H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO3-离子。
①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为___。
②实验过程中,加少量NaI固体能使反应速率加快,其原因是___。
(2)步骤Ⅱ,水合肼与IO反应的离子方程式为___。
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。上述①②③操作中,调整pH值时依次加入的试剂为___。
A.NaOH B.HI C.NH3H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有___。
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为___。
(5)将制备的NaI2H2O粗品以无水乙醇为溶剂进行重结晶。请给出合理的操作排序___。
加热乙醇→ → → → →纯品(选填序号)。
①高纯水洗涤 ②减压蒸发结晶 ③NaI2H2O粗品溶解 ④趁热过滤 ⑤真空干燥 ⑥抽滤
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)比较给出H+的能力的相对强弱:H2CO3___C6H5OH(填“>”、“<”或“=”);用一个离子方程式说明CO32和C6H5O结合H+能力的相对强弱___。
(2)Ca(CN)2是离子化合物,各原子均满足8电子稳定结构。写出Ca(CN)2的电子式___。
(3)常压下,水晶的硬度比晶体硅的硬度大,其主要原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C、D的位置如图所示,室温下D单质为淡黄色固体。
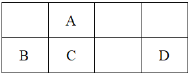
回答下列问题:
(1)C元素在周期表中的位置___,其在自然界中常见的氧化物是___晶体。
(2)A的单质在充足的氧气中燃烧得到的产物的结构式是___,其分子是__分子(“极性”或“非极性”)。
(3)四种元素中可用于航空航天合金材料的制备,其最高价氧化物的水化物的电离方程式为___。
(4)与B同周期最活泼的金属是___,如何证明它比B活泼?(结合有关的方程式进行说明)__。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国自主知识产权的首套煤基乙醇工业化项目的生产过程:先用煤制得乙酸甲酯,再将乙酸甲酯转化为乙醇。乙酸甲酯转化为乙醇涉及反应原理:
主反应:CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) ΔH1=-23.61kJmol-1
C2H5OH(g)+CH3OH(g) ΔH1=-23.61kJmol-1
副反应:CH3COOCH3(g)+C2H5OH(g)![]() CH3COOC2H5(g)+CH3OH(g) ΔH2=0.99kJmol-1
CH3COOC2H5(g)+CH3OH(g) ΔH2=0.99kJmol-1
在催化剂作用下的反应历程为(*表示吸附态)
化学吸附:H2→2H*
表面反应:CH3COOCH3+4H*→CH3CH2OH*+CH3OH*
化学脱附:CH3CH2OH*→CH3CH2OHCH3OH*→CH3OH
已知:化学吸附的活化能大,决定主反应的反应速率。
(1)2CH3COOCH3(g)+2H2(g)![]() CH3COOC2H5(g)+2CH3OH(g) ΔH3则ΔH3=___。
CH3COOC2H5(g)+2CH3OH(g) ΔH3则ΔH3=___。
(2)下列条件,有利于提高C2H5OH平衡产率的是___。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)在1L密闭容器中充入1mol乙酸甲酯,乙酸甲酯的平衡转化率与温度和氢酯比(x)[x=![]() ]的关系如图1。
]的关系如图1。
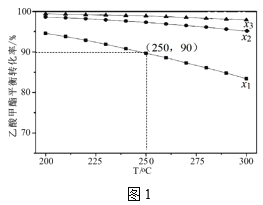
①x1、x2、x3的大小关系为___。
②250℃、x1=10,C2H5OH的选择性为60%,则主反应的平衡常数为___(保留2位有效数字)。(如乙醇选择性=![]() )
)
(4)其它条件相同,反应经过相同时间,乙酸甲酯的转化率与乙醇的选择性随氢酯比的关系如图2所示。氢酯比(x)在2~9之间,乙醇的选择性逐渐增大的原因为___。
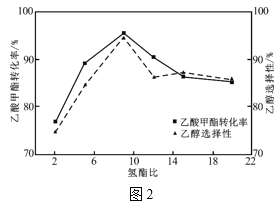
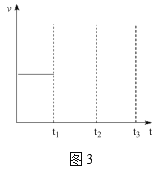
(5)若仅发生主反应,在恒压条件下,充入乙酸甲酯和氢气各2mol一段时间后达平衡,若在t1时刻再充入各1mol的反应物(其它条件不变),t2时重新达到平衡,请在图3中画出t1~t3的正逆反应速率变化的示意图。___。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可用如下方法制取Cl2:
①MnO2 +4HCl(浓)![]() Cl2↑+ MnCl2+ 2H2O
Cl2↑+ MnCl2+ 2H2O
②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
根据相关信息,回答下列问题:
(1)在反应①中,HCl表现的性质有______、________。
(2)若反应①中有0.1mol的氧化剂被还原,则被氧化的物质的物质的量为____。
(3)将(2)生成的氯气与0.2mol H2完全反应,将产物溶于水配成100mL溶液,此溶液的物质的量浓度为_______。
(4)若要制得相同质量的氯气,①②③三个反应中电子转移的数目之比为____。
(5)已知反应4HCl(g)+O2  2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为_______。
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为_______。
(6)将不纯的NaOH样品2.50 g(样品含少量Na2CO3和水),放入50.0 mL 2.00mol/L盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40.0 mL 1.00 mol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】称取58.7克Ba(OH)2和BaCl2固体混合物,配成500mL溶液,把该溶液分成5等份后分别加入相同浓度不同体积的NaHCO3溶液,生成沉淀的质量如下表。已知加入NaHCO3溶液体积为80.0mL时,反应后溶液呈中性。
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
NaHCO3溶液(mL) | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
沉淀的质量(g) | 1.97 | 3.94 | 5.91 | 7.88 | 7.88 |
(1)NaHCO3溶液中溶质的物质的量浓度______________________。
(2)原固体混合物中Ba(OH)2和BaCl2的物质的量之比__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体X可能含有Na2O2、Fe2O3、Al2O3、SiO2、K2SO4、Na2SO3、NH4NO3、MgCl2中的一种或几种物质,进行如下实验以确定其组成:
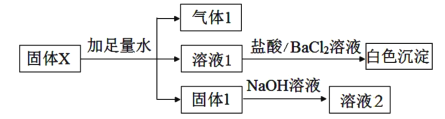
下列说法不正确的是( )
A.溶液1中不可能含有Cl-
B.气体1可能是二种气体的混合物
C.固体1可能是二种固体的混合物
D.固体X中,K2SO4和Na2SO3两种物质至少含一种
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、M为短周期主族元素。25℃时,其最高价氧化物对应的水化物(浓度均为0.01mol·L-1)溶液的pH和原子半径的关系如图所示。下列有关说法不正确的是( )
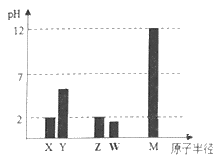
A.最简单气态氢化物的热稳定性:Z>W
B.Y的最高价氧化物的电子式为:![]()
C.W的气态氢化物是强酸
D.X、M两种元素形成的简单离子半径大小顺序:X>M
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com