
科目: 来源: 题型:
【题目】在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+ N(g)![]() E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2molL-1.下列说法正确的是( )
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2molL-1.下列说法正确的是( )
A. 4min时,M的转化率为80%
B. 4min时,用M表示的反应速率为0.8molL-1min-1
C. 4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D. 2min时,M的物质的量浓度为0.6molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:
X(g)+ 3Y(g) ![]() 2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
选项 | 改变条件 | 新平衡与原平衡比较 |
A | 升高温度 | X的转化率变小 |
B | 增大压强 | X的浓度变小 |
C | 充入一定量Y | Y的转化率增大 |
D | 使用适当催化剂 | X的体积分数变小 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】四氢铝锂(LiAlH4)常作为有机合成的重要还原剂。工业上以辉锂矿(主要成分是LiAlSi2O6,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
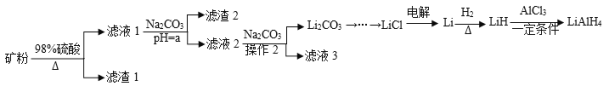
已知:金属氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4 |
完全沉淀的pH | 3.7 | 6.5 |
请回答:
(1)写出LiAlSi2O6与硫酸反应的化学方程式__。滤渣2的主要成分为__(填化学式),“a”的最小值为__。
(2)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系如下表所示。操作2中,蒸发浓缩后必须趁热过滤,其原因是__,90℃时Ksp(Li2CO3)的值为__。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(3)流程中由LiC1制备金属Li的电解条件是__。
(4)为测定制备的四氢铝锂(LiAlH4)的纯度,称取样品ag加入水使其完全反应后,收集到标况下气体VmL,
①LiAlH4溶解时发生反应的化学方程式为__。
②样品的纯度为__(列出数学表达式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】由三种元素组成的化合物A,按如图流程进行实验:
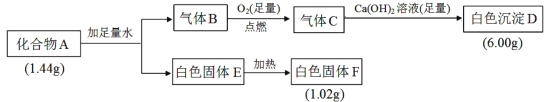
已知:①气体B为纯净物。②固体E既能溶于NaOH溶液又能溶于盐酸。
请回答:
(1)组成A的三种元素是___,A的化学式是___。
(2)固体A与足量稀盐酸反应的化学方程式是___。
(3)气体B与足量CuO在加热条件下反应,请写出一个可能的化学方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目: 来源: 题型:
【题目】制备锌印刷电路板是用稀硝酸腐蚀锌板产生的废液称“烂板液”。“烂板液”中除含硝酸锌外,还含有自来水带入的Cl-和Fe3+,在实验室里,用“烂板液制取ZnSO47HO的过程如图所示
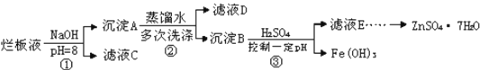
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是_________
(2)若步骤①的pH>12,则Zn(OH) 2溶解生成偏锌酸钠,Zn(OH) 2溶解的离子方程式为___________________________
(3)滤液D中除了含有OH-离子外,还含有的阴离子有___________(填离子符号)
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,(Fe3+)=2.6×10-9mo·L-l试求出Fe(OH)3的溶度积常数________________(只写结果)
(5)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq)H=a kJ mol·L-1
②H2O(l) H+(aq)+OH-(aq)H=b kJ·mol·L-1
若①的溶度积常数为Ksp,②的离子积常数为Kw,Fe3+发生水解反应的平衡常数:K=______________(用含Kw、Ksp的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,摩尔质量用M表示)样品的纯度,将mg样品分为10等份,取其中一份于强碱溶液中,加热煮沸,蒸出所有氨气,用V1mLc1molL1稀硫酸充分吸收,吸收后的溶液用c2molL1NaOH中和,平均消耗NaOH溶液的体积为V2mL。
(1)该样品中[Co(NH3)5Cl]Cl2的纯度为___;
(2)写出简要计算过程:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组为探究SO2与Fe(NO3)3稀溶液反应的情况,实验装置如图:
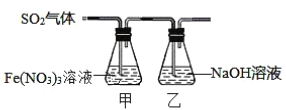
请回答:
(1)实验过程中,甲中溶液由黄色变为浅绿色但立即又变为黄色。请写出甲中溶液由浅绿色变为黄色的离子方程式___。
(2)请设计实验方案,检验反应后甲溶液中的金属阳离子___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com