
科目: 来源: 题型:
【题目】小颖同学用如图所示装置研究原电池原理,下列说法错误的是( )

A.若将图1装置的Zn、Cu直接接触,Cu片上能看到气泡产生
B.图2装置中![]() 向Cu片移动
向Cu片移动
C.若将图2中的Zn片改为Mg片,Cu片上产生气泡的速率加快
D.图2与图3中正极生成物的质量比为1:32时,Zn片减轻的质量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是

A. a为负极,是铁片,烧杯中的溶液为硫酸
B. b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C. a为正极,是碳棒,烧杯中的溶液为硫酸
D. b为正极,是碳棒,烧杯中的溶液为硫酸铜
查看答案和解析>>
科目: 来源: 题型:
【题目】碘是人体必需的微量元素之一,我国以前在食盐中加KI加工碘盐。
(1) 目前加碘食盐中,不用KI的主要原因是__________________________。
(2) 将Fe3I8加入到K2CO3溶液中,生成Fe3O4、KI和一种气体,该反应的化学方程式为__________。
(3) 准确称取某KI样品3.500 0 g配制成100.00 mL溶液;取25.00 mL所配溶液置于锥形瓶中,加入15.00 mL 0.100 0 mol·L-1 K2Cr2O7酸性溶液(Cr2O72-转化为Cr3+),充分反应后,煮沸除去生成的I2;冷却后加入过量KI,用0.200 0 mol·L-1 Na2S2O3标准溶液滴定至终点(I2和S2O32-反应生成I-和S4O62-),消耗Na2S2O3标准溶液24.00 mL。计算该样品中KI的质量分数____________ (写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料。 LiFePO4可用FeCl3、NH4H2PO4、LiCl和苯胺(![]() )等作为原料制备。
)等作为原料制备。
(1) Fe2+基态核外电子排布式为________,PO43-的空间构型为________(用文字描述)。
(2) NH4H2PO4中,除氢元素外,其余三种元素第一电离能最大的是____(填元素符号)。
(3) 1 mol![]() 含有的σ键数目为___,苯胺的沸点高于甲苯的主要原因是________。
含有的σ键数目为___,苯胺的沸点高于甲苯的主要原因是________。
(4) 一个LiCl晶胞(如图)中,Li+数目为________。
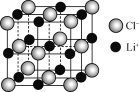
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(CH3OCH3)是重要的能源物质,其制备、应用与转化是研究的热点。
(1) 利用合成气制备二甲醚主要包含三个反应:
CO(g)+2H2(g)=CH3OH(g);ΔH=-90.4 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g);ΔH=-23.4 kJ·mol-1
CO(g) +H2O(g)=H2(g)+CO2(g);ΔH=-41.0 kJ·mol-1
则3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g);ΔH=________。
(2) 某二甲醚/双氧水燃料电池的工作原理如图1所示。电池工作时,电极A附近溶液pH________(填“减小”“增大”或“不变”);电极B的电极反应式为_____________。

(3) 二甲醚催化羰化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g)=CH3COOCH3(g);ΔH1
反应Ⅱ:CH3COOCH3(g)+2H2(g)=CH3CH2OH(g)+CH3OH(g);ΔH2
反应Ⅰ、Ⅱ的平衡常数的对数lg K1、lg K2与温度的关系如图2所示;在固定CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图3所示。
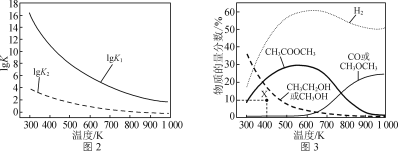
① ΔH1________(填“>”“<”或“=”)0。
②300~400 K时,CH3CH2OH物质的量分数随温度升高而降低的原因是________。
③ 600~700 K时,CH3COOCH3物质的量分数随温度升高而降低的原因是________。
④ 400 K时,在催化剂作用下,反应一段时间后,测得CH3CH2OH物质的量分数为10%(图3中X点)。不改变原料比、温度和压强,一定能提高CH3CH2OH物质的量分数的措施有________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如何除去杂质、提纯下列各物质?请在表中填空。
混合物成分 | 提纯所用试剂的化学式 | 离子方程式 |
(1)FeCl2中含少量FeCl3杂质 | _______ | __________________ |
(2)FeCl3中含少量FeCl2杂质 | _______ | __________________ |
(3)FeSO4中含少量CuSO4杂质 | _______ | __________________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】Deacon法制备Cl2的反应为4HCl(g)+O2(g)2Cl2(g)+2H2O(g)。如图为恒容容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系。下列说法正确的是( )
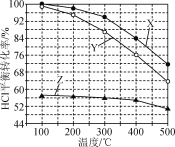
A.反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的ΔH>0
B.Z曲线对应进料浓度比c(HCl)∶c(O2)=7∶1
C.400 ℃,进料浓度比c(HCl)∶c(O2)=4∶1时,O2平衡转化率为19%
D.400 ℃,进料浓度比c(HCl)∶c(O2)=1∶1时,c起始(HCl)=c0 mol·L-1,平衡常数K=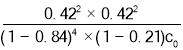
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。氨水可用于工业尾气中SO2的吸收。下列指定溶液中微粒的物质的量浓度关系正确的是( )
A.氨水与SO2反应恰好生成(NH4)2SO3时:c(NH4+)>c(SO32-)>c(OH-)>c(H+)
B.氨水与SO2反应所得溶液pH=9时:c(NH4+)+c(H+)<3c(HSO3-)+c(OH-)
C.氨水与SO2反应生成等物质的量NH4HSO3和(NH4)2SO3时:3c(NH4+)+3c(NH3·H2O)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)
D.氨水与SO2反应恰好生成NH4HSO3时:c(H+)+c(H2SO3)=c(OH-)+c(SO32-)+c(NH3·H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】羟甲香豆素(Z)是一种治疗胆结石的药物。其合成涉及如下转化:

下列有关说法正确的是( )
A.X和Y分子中各含有1个手性碳原子
B.Y能发生加成反应、取代反应和消去反应
C.1 mol Y与足量NaOH溶液反应,最多消耗2 mol NaOH
D.1 mol Z与足量浓溴水反应,最多消耗2 mol Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com