
科目: 来源: 题型:
【题目】铝是地壳中含量最高的金属元素,化学性质活泼。
(1)在通常情况下,金属铝制品能稳定地存在,不被氧化且不跟水作用,是因为______
(2)将在空气中长时间放置的铝条浸入6mol/L的氢氧化钠溶液中,发现刚开始没有气泡,后来出现大量气泡。出现这一现象的原因是(用文字和方程式表述)____________
(3)明矾是常见的净水剂,写出明矾净水的原因(用文字和方程式表述)____________
查看答案和解析>>
科目: 来源: 题型:
【题目】向20mL含有1mol/L的氯化铝和一定量盐酸的溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,产生沉淀的质量与所加碱的体积如图所示:
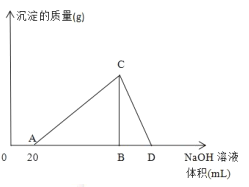
(1)写出AC段和CD段发生反应的离子方程式:
AC_______________________________________
CD_______________________________________
(2)盐酸溶液的浓度是____________________。
(3)若产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积可能是__________________。
(4)D点表示的氢氧化钠溶液的体积是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)甲烷与氧气反应的化学方程式为:
(2)已知燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-= CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
(3)随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
(4)通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对于实验装置的有关说法错误的是( )
A.装置Ⅰ:可以用来验证碳的非金属性比硅强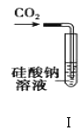
B.装置Ⅱ:可以用来比较Na2CO3和NaHCO3的热稳定性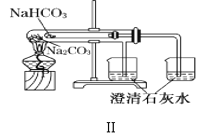
C.装置Ⅲ:先从①口进气收集满二氧化碳,再从②口进气,则可收集NO气体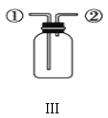
D.装置Ⅳ:可以用于制备Fe(OH)2并能保证相对较长时间观察到白色沉淀Fe(OH)2 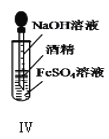
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入 6mol/L 的硫酸溶液,乙同学将电极放入 6mol/L 的氢氧化钠溶液中,如图所示:
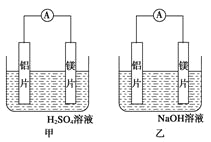
(1)写出甲电池中正极的电极反应式___________________ ;
(2)写出乙池中负极的电极反应式: 负极:_____ 总反应的离子方程式:_________
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金 属,则构成负极材料的金属活泼
,则甲会判断出_____活动性更强,而乙会判断出_____活动性更强(填名称)
(4)由此实验,可得到如下哪些正确结论(_____)
a. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b. 镁的金属性不一定比铝的强
c. 该实验说明金属活动性顺序表已过时,已没有利用价值
d. 该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法__填 “可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_______________ (如 可靠,可不填)
查看答案和解析>>
科目: 来源: 题型:
【题目】美国北卡罗来纳大学的一项新研究表明,一种名为EIDD2801的新药有望改变医生治疗新冠肺炎的方式,有效减少肺损伤。其结构简式如图,下列有关EIDD2801的说法不正确的是( )
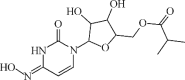
A.EIDD2801包含的含氧官能团有4种
B.EIDD2801分子中所有原子可能在同一平面上
C.EIDD2801一定条件下能和乙二酸发生聚合反应
D.EIDD2801能够使酸性高锰酸钾溶液或溴水等褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】通过对阳极泥的综合处理可以回收宝贵的金属,一种从铜阳极泥(主要成分为Se、Ag2Se、Ag、Cu、CuSO4和Cu2S等)中分离Ag、Se和Cu的新工艺流程如图所示:
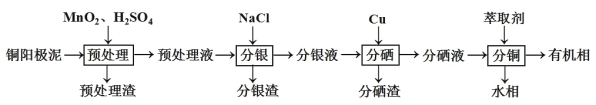
(1)已知预处理温度为80℃,预处理渣中几乎不含有单质S,则预处理时Cu2S发生反应的离子方程式为___。从环保角度来看,本工艺中采用稀H2SO4添加适量MnO2做预处理剂与传统工艺中采用浓硫酸作氧化剂相比的主要优点是___。
(2)回收分银渣中的银,可用如图过程:
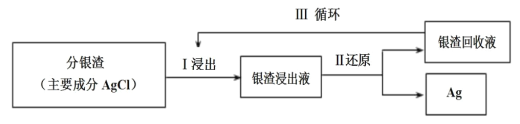
已知:S2O![]() -易与银离子发生络合反应:Ag++2S2O
-易与银离子发生络合反应:Ag++2S2O![]()
![]() Ag(S2O3)
Ag(S2O3)![]() 。在常温下,上述络合反应的平衡常数为:K稳[Ag(S2O3)
。在常温下,上述络合反应的平衡常数为:K稳[Ag(S2O3)![]() ]=
]=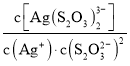 =2.8×1013,Ksp(AgCl)=1.8×10-10
=2.8×1013,Ksp(AgCl)=1.8×10-10
①Ⅰ中发生的离子反应方程式为:AgCl(s)+2S2O![]()
![]() Ag(S2O3)
Ag(S2O3) ![]() (aq)+Cl-(aq),则常温下此反应的平衡常数K为___(结果保留二位小数)。
(aq)+Cl-(aq),则常温下此反应的平衡常数K为___(结果保留二位小数)。
②Ⅲ中银渣回收液可直接循环使用,但循环多次后,银的浸出率会降低。从化学平衡的角度分析原因:___。
(3)分硒渣的主要成分是Cu2Se,可被氧化得到亚硒酸(H2SeO3)。已知常温下H2SeO3的Ka1=2.7×10-3,Ka2=2.5×10-8,则NaHSeO3溶液的pH___7(填“>”、“<”或“=”)。硒酸(H2SeO4)可以用氯水氧化亚硒酸得到,该反应化学方程式为___。
(4)分铜得到产品CuSO4·5H2O的具体操作如图:

其中萃取与反萃取原理为:2RH+Cu2+![]() R2Cu+2H+,反萃取剂最好选用___(填化学式)溶液。
R2Cu+2H+,反萃取剂最好选用___(填化学式)溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为原电池装置示意图。
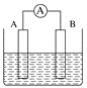
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式____
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式___,该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____;该电池在工作一段时间后,溶液的碱性将_____(填“增强”“减弱”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机合成的重要中间体F的一种合成路线如下:
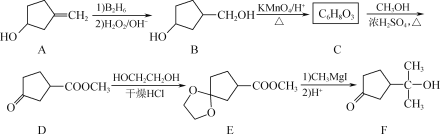
(1) F中含氧官能团的名称是________、________。
(2) C的结构简式为________。
(3) 从整个流程看,D→E的作用是___________。
(4) G为比E相对分子质量大14的同系物,H与G互为同分异构体且符合下列条件:
① 1 mol H能与2 mol NaHCO3反应;
② H能使溴的四氯化碳溶液褪色;
③ H分子中含有3种不同化学环境的氢。
则H的结构简式为________(写一种)。
(5) 写出以![]() 、CH3OH和CH3CH2MgI为主要原料制备
、CH3OH和CH3CH2MgI为主要原料制备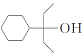 的合成路线____________ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线____________ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目: 来源: 题型:
【题目】为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取a g样品,向其中加入足量的氢氧化钠溶液,测得生成的气体(标准状况,下同)体积为b L,样品中铝的质量是______________g。
(2)若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是:_______________________,氧化铁与铝的质量比是_____________。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c:b__________。
(4)用铝热法还原下列物质,制得金属各1mol,消耗铝最少的是____________
A.MnO2 B.Fe3O4 C.Cr2O3 D. V2O5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com