
科目: 来源: 题型:
【题目】呋喃甲酸俗称糠酸,广泛应用于塑料工业、食品行业、涂料、医药、香料等。用呋喃甲醛制备呋喃甲酸和副产品呋喃甲醇的原理为:
反应1:![]() +NaOH
+NaOH![]()
![]() △H<0
△H<0
反应2:![]() +HCl
+HCl![]()
![]() +HCl
+HCl
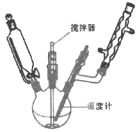
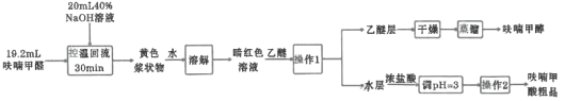
某研究性学习小组利用上图装置制备呋喃甲酸的实验流程如下:
已知:①乙醚(![]() )沸点34.6℃,其蒸气有毒,可使人失去知觉。
)沸点34.6℃,其蒸气有毒,可使人失去知觉。
②主要试剂相关物理性质如下:
试剂 | 相对分子质量 | 密度/ | 熔点/℃ | 沸点/℃ | 溶解性 |
呋喃甲醛 | 96 | 1.16 |
| 161.7 | 微溶于水,易溶于乙醇、乙醚。 |
呋喃甲醇 | 98 | 1.13 |
| 171.0 | 溶于水,可混溶于乙醇、乙醚。 |
呋喃甲酸 | 112 | - | 129.5 | 231.0 | 微溶于冷水,在热水中溶解度较大,易溶于乙醇、乙醚。 |
请回答下列问题:
(1)“控温回流”时需控制反应温度8~12℃,应采取的控温方式是________,三颈烧瓶中所加入的![]() 溶液应如何预处理________,滴加呋喃甲醛时需________。
溶液应如何预处理________,滴加呋喃甲醛时需________。
(2)在“控温回流”时充分搅拌才能获得较高产率。其原因是________。
(3)“操作1”的名称为________,所用到的玻璃仪器主要有________,“操作2”主要包括________、________。
(4)“蒸馏”时,用下图________(填字母标号)装置更好,与另一装置相比,该装置的优点有①________;②________。
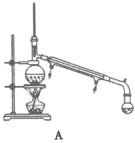
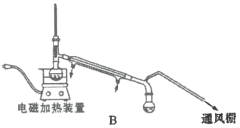
(5)呋喃甲酸粗品精制所采用的方法是________,最终得到精产品9.86g,呋喃甲酸的产率为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为![]() ,
,![]() 。
。
(1)“中国蓝”、“中国紫”中均具有![]() 离子,
离子,![]() ________,基态时该阳离子的价电子排布式为________。
________,基态时该阳离子的价电子排布式为________。
(2)合成“中国蓝”、“中国紫”的原料有![]() ,孔雀石
,孔雀石![]() 和砂子(
和砂子(![]() )。现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源于一种阴离子的立体结构型是正四面体的天然钡矿中,则该钡矿主要成分化学式是________。
)。现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源于一种阴离子的立体结构型是正四面体的天然钡矿中,则该钡矿主要成分化学式是________。
(3)在5500年前,古代埃及人就已经知道如何合成蓝色颜料—“埃及蓝”![]() ,其合成原料中用
,其合成原料中用![]() 代替了
代替了![]() ,其他和“中国蓝”一致。
,其他和“中国蓝”一致。![]() 中键角为________。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更________(填“高”或“低”)。
中键角为________。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更________(填“高”或“低”)。
(4)硝酸铜溶于氨水形成![]() 的深蓝色溶液。
的深蓝色溶液。
①![]() 中阴离子的立体构型是________。
中阴离子的立体构型是________。![]() 中心原子的轨道杂化类型为________。
中心原子的轨道杂化类型为________。
②氨气在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因________。
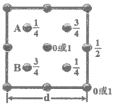
(5)自然界中的![]() 硬度较大,主要原因是________。下图为
硬度较大,主要原因是________。下图为![]() 晶胞中
晶胞中![]() 原子沿
原子沿![]() 轴方向在
轴方向在![]() 平面的投影图(即俯视图),其中
平面的投影图(即俯视图),其中![]() 原子略去,
原子略去,![]() 原子旁标注的数字表示每个
原子旁标注的数字表示每个![]() 原子位于
原子位于![]() 轴的高度,则
轴的高度,则![]() 与
与![]() 的距离是________。
的距离是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于如图装置中的变化叙述错误的是
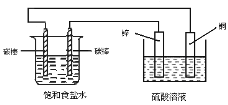
A.电子经导线从锌片流向右侧碳棒,再从左侧碳棒流回铜片
B.铜片上发生氧化反应
C.右侧碳棒上发生的反应:2H++2e→H2 ↑
D.铜电极出现气泡
查看答案和解析>>
科目: 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:![]() △H1 平衡常数为K1
△H1 平衡常数为K1
反应Ⅱ:![]() △H2 平衡常数为K2
△H2 平衡常数为K2
不同温度下,K1、K2的值如下表:
| K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应Ⅲ:![]() ,结合上表数据,反应Ⅲ是________(填“放热”或“吸热”)反应。
,结合上表数据,反应Ⅲ是________(填“放热”或“吸热”)反应。
(2)![]() 催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种![]() 转化方法,其过程中主要发生下列反应:
转化方法,其过程中主要发生下列反应:
反应Ⅲ:![]() △H3
△H3
反应Ⅳ:![]() △H=-122.5kJ/mol
△H=-122.5kJ/mol
在恒压、![]() 和
和![]() 的起始量一定的条件下,
的起始量一定的条件下,![]() 平衡转化率和平衡时
平衡转化率和平衡时![]() 的选择性随温度的变化如图。
的选择性随温度的变化如图。
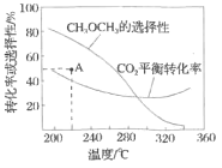
其中:![]() 的选择性
的选择性![]()
①温度高于300℃,![]() 平衡转化率随温度升高而上升的原因是________。
平衡转化率随温度升高而上升的原因是________。
②220℃时,在催化剂作用下![]() 与
与![]() 反应一段时间后,测得
反应一段时间后,测得![]() 的选择性为48%(图中
的选择性为48%(图中![]() 点)。不改变反应时间和温度,一定能提高
点)。不改变反应时间和温度,一定能提高![]() 选择性的措施有________。
选择性的措施有________。
(3)石油化工生产中,利用裂解反应可以获得重要化工原料乙烯、丙烯。一定条件下,正丁烷裂解的主反应如下:
反应Ⅴ:![]()
反应Ⅵ:![]()
一定温度下,向容积为![]() 的密闭容器中通入正丁烷,反应时间
的密闭容器中通入正丁烷,反应时间![]() 与容器内气体总压强
与容器内气体总压强![]() 数据如下:
数据如下:
| 0 | 10 | 20 | 30 | 40 |
| 5 | 7.2 | 8.4 | 8.8 | 8.8 |
①反应速率可以用单位时间内分压的变化表示,即v=![]() ,前
,前![]() 内正丁烷的平均反应速率v(正丁烷)
内正丁烷的平均反应速率v(正丁烷)![]() ________
________![]() ,该温度下,正丁烷的平衡转化率
,该温度下,正丁烷的平衡转化率![]() ________。
________。
②若平衡时乙烯的体积分数为![]() ,则该温度下反应Ⅴ的分压平衡常数Kp=________MPa(保留一位小数)。
,则该温度下反应Ⅴ的分压平衡常数Kp=________MPa(保留一位小数)。
③若反应在恒温、恒压条件下进行,平衡后反应容器的体积________![]() (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,分别向体积均为20mL、浓度均为0.1mol/L的HX、HY溶液中滴加同浓度的Ba(OH)2溶液(Ba2+与X-、Y-均不反应)。已知pOH水![]() 水(OH-),
水(OH-),![]() 水(OH-)为反应后溶液中由水电离产生的氢氧根离子浓度。pOH水与滴加Ba(OH)2溶液的体积关系如图所示。下列说法不正确的是( )。
水(OH-)为反应后溶液中由水电离产生的氢氧根离子浓度。pOH水与滴加Ba(OH)2溶液的体积关系如图所示。下列说法不正确的是( )。
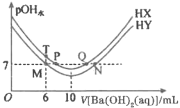
A.室温下,Ka(HX)>Ka(HY)
B.Q点溶液呈中性,溶液中c(X-)=2c(Ba2+)
C.T点溶液中阴离子浓度之和大于M点
D.室温下,水解常数Kh(Y-)=6.7×10-8
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如图所示,回答下列问题。

(1)加入过量A溶解后,在进行操作a时玻璃棒的作用是______________________。
(2)工厂废液中加入过量A的目的是______________________________。
(3)溶液甲中的金属离子是_____________________(写离子符号)。
(4)步骤①②③中所发生的化学反应,其中属于置换反应的是________(填序号)。
(5)步骤③中发生反应的化学方程式是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图装置探究铁在海水中的电化学防护,下列说法不正确的是

A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe2e =Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e=H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和盐酸,各加入生铁块,放置一段时间。下列有关描述错误( )
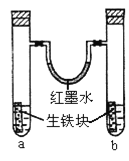
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左高右低
C.两试管中相同的电极反应式是:Fe-3e-=Fe3+
D.a试管中发生了吸氧腐蚀,b试管发生了析氢腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】用下图所示装置进行如下实验,能达到实验目的的是

A. 瓶中盛满水,从B口进气,用排水法收集HCl气体
B. 瓶中盛适量浓硫酸,从A口进气来干燥NH3
C. 从B口进气,用排空气法收集CO2
D. 瓶中盛满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
查看答案和解析>>
科目: 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com