
科目: 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1∶2;②NO2的生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧
C. 只有①④ D. 只有⑦⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】关于Na2CO3与NaHCO3的性质判断正确的是
A.常温下溶解度:Na2CO3<NaHCO3
B.与同浓度同体积的盐酸反应的速率:Na2CO3>NaHCO3
C.热稳定性:Na2CO3<NaHCO3
D.与澄清石灰水反应,均有白色沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式不正确的是
A.硫酸铝溶液中加入氢氧化钡溶液:Ba2++![]() == BaSO4↓
== BaSO4↓
B.硫酸亚铁溶液中加入过氧化氢溶液:2Fe2+ + H2O2 + 2H+ == 2Fe3+ + 2H2O
C.向NaHCO3 溶液中加入NaOH溶液:![]() + OH-==
+ OH-==![]() + H2O
+ H2O
D.向AgCl悬浊液中加入Na2S溶液:2AgCl + S2-== Ag2S + 2Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】研究光盘金属层含有的Ag(其它金属微量忽略不计)、丢弃电池中的Ag2O等废旧资源的回收利用意义重大。下图为从光盘中提取Ag的工业流程,请回答下列问题。
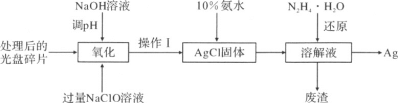
(1)NaClO溶液在受热或酸性条件下易分解,“氧化”阶段需在80℃条件下进行,适宜的加热方式为 _____。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为______。有人提出以HNO3代替NaClO氧化Ag,从反应产物的角度分析,其缺点是_______。
(3)操作Ⅰ的名称为_______。化学上常用10%的氨水溶解AgCl固体,AgCl与NH3·H2O按1:2反应可生成Cl-和一种阳离子__________的溶液(填阳离子的化学式)。实际反应中,即使氨水过量也不能将AgCl固体全部溶解,可能的原因是_______。
(4)常温时N2H4·H2O(水合肼)在碱性条件下能还原(3)中生成的阳离子,自身转化为无害气体N2,理论上消耗0.1 mol的水合肼可提取到 ______g的单质Ag。
(5)废旧电池中Ag2O能将有毒气体甲醛(HCHO)氧化成CO2,科学家据此原理将上述过程设计为原电池回收电极材料Ag并有效去除毒气甲醛。则此电池的正极反应式为 _____,负极的产物有____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组研究NH4Cl与CuO的反应,进行如下实验(部分装置略):
实验 | Ⅰ | Ⅱ |
装置 |
|
|
现象 | 加热试管,产生白烟,试管口有白色固体;试管中有水生成,继续加热,黑色固体变蓝,最终部分变为黄色 | 将细玻璃管口加热至红热,迅速垂直插入 NH4Cl晶体中,一段时间后,取出玻璃管,管口处有亮红色固体 |
经检测,实验Ⅰ中的黄色固体含有CuCl和CuCl2,实验Ⅱ中的亮红色固体为Cu。
(1)实验Ⅰ中试管口的白色固体是______。
(2)实验Ⅰ中黑色固体变蓝,最终部分固体变为黄色的过程中,发生了如下变化:
![]()
①(NH4)2CuCl4固体受热分解的化学方程式是______。
②对于物质X,做出如下假设:
ⅰ.X是NH4Cl。
反应方程式为:________________________________(补充完整)
ⅱ.X是______,理由是______。
(3)实验Ⅰ和实验Ⅱ的现象不同,可能的原因是______(列出2点)。
(4)NH4Cl溶液与CuO反应。
实验Ⅲ 向CuO粉末中加入0.1 mol·L1 NH4Cl溶液,浸泡一段时间后,固体部分溶解,表面无颜色变化,溶液变为蓝色。
资料:ⅰ.相关微粒在水溶液中的颜色:Cu2+蓝色,Cu(NH3)2+和Cu(NH3)42+深蓝色
ⅱ.Cu(NH3)2+![]() Cu2++NH3 Cu(NH3)42+
Cu2++NH3 Cu(NH3)42+![]() Cu2++4NH3
Cu2++4NH3
①设计实验证明实验Ⅲ得到的蓝色溶液中存在Cu(NH3)2+或Cu(NH3)42+。
实验方案是______。
②实验Ⅲ中未观察到NH4Cl溶液与CuO发生氧化还原反应的产物,可能的原因是______(列出1点即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2
B. 一定条件下,2.3 g的Na完全与O2反应生成3.6 g产物,失去的电子数为0.2 NA
C. 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D. 金属钠着火时使用泡沫灭火器灭火
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,下列叙述正确的是
A. 78g苯中含有的碳碳双键的数目为3NA
B. 16gCu2S和CuO组成的混合物中含有的阳离子数为0.2NA
C. 将1mol H2与 1 mol I2充入一密闭容器中充分反应后,转移的电子书为2NA
D. 1 mol Fe 与足量的浓硫酸共热反应,生成SO2的分子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化六氨合钴([Co(NH3)6]Cl3)是一种橙黄色晶体,实验室制备过程如下:
Ⅰ.将研细的6 g CoCl26H2O晶体和4 g NH4Cl固体加入锥形瓶中,加水,加热溶解,冷却;
Ⅱ.加入13.5 mL浓氨水,用活性炭作催化剂,混合均匀后逐滴滴加13.5 mL 5% H2O2溶液,水浴加热至50~60℃,保持20 min。用冰浴冷却,过滤,得粗产品;
Ⅲ.将粗产品溶于50 mL热的稀盐酸中,______,向滤液中缓慢加入6.7 mL浓盐酸,有大量橙黄色晶体析出,冰浴冷却后过滤;
Ⅳ.先用冷的2 mol·L1 HCl溶液洗涤晶体,再用少许乙醇洗涤,干燥,得产品。
(1)[Co(NH3)6]Cl3中Co的化合价是______。
(2)CoCl2遇浓氨水生成Co(OH)2沉淀,加入浓氨水前先加入NH4Cl可避免沉淀生成,原因是______。
(3)溶液中CoCl2、NH4Cl和浓氨水混合后,与H2O2溶液反应生成[Co(NH3)6]Cl3的化学方程式是______。
(4)补全Ⅲ中的操作:______。
(5)沉淀滴定法测定制备的产品中Cl-的质量分数:
ⅰ.准确称取a g Ⅳ中的产品,配制成100 mL溶液,移取25 mL溶液于锥形瓶中;
ⅱ.滴加少量0.005 mol·L1 K2CrO4溶液作为指示剂,用c mol·L1 AgNO3溶液滴定至终点;
ⅲ.平行测定三次,消耗AgNO3溶液的体积的平均值为v mL,计算晶体中Cl-的质量分数。
已知:溶解度:AgCl 1.3×106 mol·L1,Ag2CrO4(砖红色)6.5×105 mol·L1
①ⅱ中,滴定至终点的现象是______。
②制备的晶体中Cl-的质量分数是______(列计算式,Cl的相对原子质量:35.5)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表中的一部分,列出10种元素在元素周期表中的位置.用化学符号回答下列各问题.
周期 |
|
|
|
|
|
|
| 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)10种元素中,化学性质最不活泼的是_________.
(2)①、③、⑤三种元素最高价氧化物对应水化物中,碱性最强的是_________.
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_________.
(4)元素⑦的简单氢化物的化学式为_____;若该氢化物和元素⑨的单质反应,则化学方程式为_______.
(5)⑤和⑨的最高价氧化物对应水化物的化学式分别为_________和_________.
(6)①和⑤最高价氧化物对应水化物相互反应的离子方程式为__________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com