
科目: 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容,引起了人们的研究兴趣。
(1)现有以下三种乙醇燃料电池(DEFC)。

①碱性乙醇燃料电池中,电极a上发生的电极反应式为____。
②酸性乙醇燃料电池中,电极b上发生的电极反应式为___。
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电极b上发生的电极反应式为___。
(2)0.4mol CuSO4和0.4molNaCl溶于水,配成1L溶液,用惰性电极进行电解,当一个电极得到0.3molCu时,另一个电极上生成的气体在标准状况下的体积为___L。
(3)新型绿色硝化剂N2O5可以N2O4为原料用电解法制备,实验装置如图所示,则电极B接直流电源的___极,电解池中生成N2O5的电极反应式为___。

查看答案和解析>>
科目: 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后(盐酸有剩余),再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。下列说法中错误的是( )
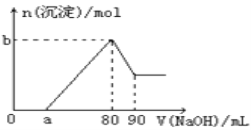
A. 盐酸的体积为80mL
B. a的取值范围为0<a<50
C. 当a值为30时,b值为0.01
D. n(Mg2+)<0.025mol
查看答案和解析>>
科目: 来源: 题型:
【题目】一种零价铁纳米簇可用于水体修复,其处理三氯乙烯(![]() )所形成原电池如图所示。水体中
)所形成原电池如图所示。水体中![]() ,
,![]() ,
,![]() 等离子也发生反应。下列说法正确的是( )
等离子也发生反应。下列说法正确的是( )
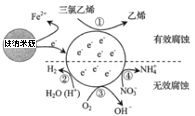
A.零价铁纳米簇发生的电极反应为:Fe-3e-=Fe3+
B.反应①在正极发生,反应②③④在负极发生
C.③的电极反应式为4OH--4e-=O2↑+2H2O
D.三氯乙烯脱去3mol Cl时反应①转移6mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列根据实验操作及现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 测定等浓度的 | 前者pH比后者大 | 非金属性:S>C |
B | 将NaCl晶体分散在乙醇中,用激光笔照射 | 出现光亮的通路 | 该分散系为胶体 |
C | 向溶液中加入盐酸酸化的 | 产生白色沉淀 | 溶液中含有 |
D | 向填充有经硫酸处理的 | 固体由橙色变为绿色 | 乙醇具有氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:2NO(g)+O2(g)2NO2(g)△H=-113.0kJmol-1,2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1;SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为__。
②随温度升高,该反应化学平衡常数变化趋势是___。
(2)提高2SO2+O22SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0molSO2和1.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是__。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是___(填字母)。
a.温度和容器体积不变,充入1.0molHe b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,减少容器的体积 d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下pH为2的盐酸,下列叙述正确的是( )
A.将10mL该溶液稀释至100mL后,pH=4
B.向该溶液中加入等体积pH为12的氨水恰好完全中和
C.该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010:1
D.该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】在如图串联装置中,通电片刻即发现乙装置左侧电极表面出现红色固体,则下列说法不正确的是( )
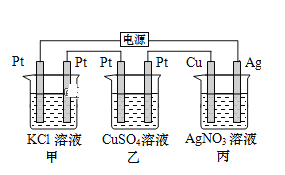
A.标准状况下当甲中产生4.48L气体时,丙中Cu电极质量增加21.6g
B.电解过程中丙中溶液pH无变化
C.向甲中加入适量的盐酸,可使溶液恢复到电解前的状态
D.乙中左侧电极反应式:Cu2++2e-=Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】随着新能源汽车产业的快速发展,带来大量的废旧电池,一种以废旧磷酸铁锂电池正极为原料回收铝、铁和锂元素的工艺流程如下:

已知:①![]() 易溶于硫酸中。
易溶于硫酸中。
②磷酸铁锂电池正极材料:磷酸铁锂![]() ,乙炔黑(主要成分碳单质,着火点大于750℃)导电剂和有机粘结剂PVDF(一种高分子有机物),均匀混合后涂覆于铝箔上。
,乙炔黑(主要成分碳单质,着火点大于750℃)导电剂和有机粘结剂PVDF(一种高分子有机物),均匀混合后涂覆于铝箔上。
回答下列问题:
(1)破碎的作用是________,烧结的主要目的是________。
(2)碱溶发生的非氧化还原反应的离子方程式是________________。
(3)若在实验室中进行操作1、2、3,需要用到的玻璃仪器有________。
(4)滤渣1酸浸的目的是________。
(5)滤渣2主要成分是________。
(6)pH与Fe、Li沉淀率关系如下表,为使滤液2中Fe、Li分离,溶液的pH应调节为________。
溶液pH与Fe、Li沉淀率关系
pH | 3.5 | 5 | 6.5 | 8 | 10 | 12 |
Fe沉淀率 | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
Li沉淀率 | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
(7)碳酸锂的溶解度随温度变化如下图所示。向滤液3中加入![]() ,将温度升至90℃是为了提高沉淀反应速率和________。
,将温度升至90℃是为了提高沉淀反应速率和________。

查看答案和解析>>
科目: 来源: 题型:
【题目】将2.32gNa2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况) 关系如图所示,下列说法中错误的是( )
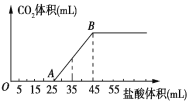
A.OA段发生反应的离子方程式为:H++OH-=H2O、CO32-+H+=HCO3-
B.A点溶液中的溶质为NaCl、NaHCO3
C.混合物中NaOH的质量0.60g
D.当加入35mL盐酸时,产生CO2的体积为224mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com