
科目: 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g)
pC(g)
(I)若达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为___热反应,且m+n__p(填“>”、“=”或“<”)。
(2)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色___;而维持容器内压强不变,充入氖气时,混合物颜色___。(填“变深”、“变浅”或“不变”)。
(II)若在容积可变的密闭容器中发生反应,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如表
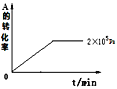
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(1)当压强从2×105Pa增加到5×105Pa时,平衡___移动(填:向左,向右,不)。
(2)维持压强为2×105Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入b molB,当重新达到平衡时,体系中气体总物质的量是___mol。
(3)当压强为1×106Pa时,此反应的平衡常数表达式:___。
(4)其他条件相同时,在上述三个压强下分别发生该反应。2×105Pa时,A的转化率随时间变化如图,请在图中补充画出压强分别为5×105Pa和1×106Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。____
查看答案和解析>>
科目: 来源: 题型:
【题目】室温时,H2S 的 Ka1 =1.0 ×10-7,Ka2 =1.0 ×10-15下列说法正确的是
A.0.1 mol L-1的 NaHS溶液中:c(S2ˉ)>c(H2S)
B.反应 S2ˉ+ H2O ![]() HSˉ+ OHˉ 的平衡常数 K=1×10-7
HSˉ+ OHˉ 的平衡常数 K=1×10-7
C.NaHS与 Na2S以任意比混合的溶液中 :c( Na+)+ c(H+)=c(HSˉ)+ c(S2ˉ)+c(OHˉ)
D.0.1 mol L-1的Na2S 溶液中:c(OHˉ)= c(H+)+ c(HSˉ) + 2c(H2S)
查看答案和解析>>
科目: 来源: 题型:
【题目】空气中CO2浓度的持续走高引起人们的高度重视。一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2。为此,他们设想了一系列“捕捉”和“封存” CO2的方法。
方法Ⅰ:一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如图所示。
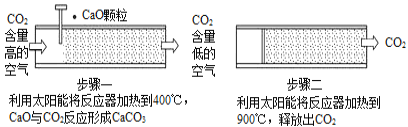
(1)步骤一中的CaO俗称____________。
(2)步骤二中发生反应的化学方程式是____________,该反应____________(填“是”或“不是”)步骤一中反应的逆反应。
方法Ⅱ:另一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如图所示。
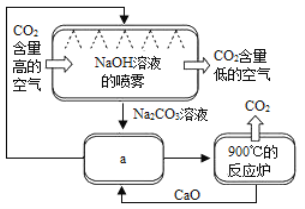
(1)NaOH溶液喷成雾状是为了_________________。
(2)上图a环节中,物质分离的基本操作是__________。
(3)为了尽量减少成本,在整个流程中,循环利用的物质有CaO和____________。
(4)下列溶液中,同样能用于“捕捉”二氧化碳的是____________。
A.KNO3溶液 B.CaCl2溶液 C.CuSO4溶液 D.Na2CO3溶液
(5)“捕捉”到的二氧化碳,一部分可以用于生产;一部分则设想注入深海中“封存”起来。但过多的二氧化碳会导致海水水质的变化,最终殃及海洋生物,其原因是_____(用化学方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
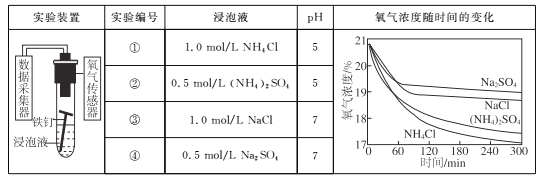
下列说法不正确的是
A. 上述正极反应均为O2+4e-+2H2O=4OH-
B. 在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C. 向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D. 在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)KMnO4作为强氧化剂,其氧化性随溶液的酸性增强而增大,在酸性介质中还原产物是Mn2+,在中性或碱性介质中还原产物主要是MnO2,试写出在酸性条件下氧化H2O2的离子方程式:_______________________。
(2)工业上可用KClO3溶液与Na2SO3溶液在稀H2SO4存在下制得ClO2气体,试写出该反应的离子方程式:_______________________。
(3)在强酸性混合稀土溶液中加入H2O2,可以将溶液中Ce3+氧化成Ce(OH)4沉淀得以分离,试写出该反应的离子方程式________________________________________________。
(4)FeCl3与KClO在强碱性条件下反应可生成K2FeO4和KCl,写出该反应的离子方程式:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
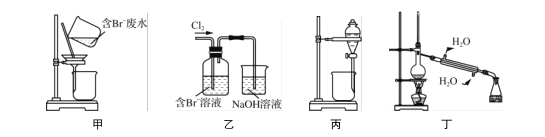
下列说法正确的是( )
A. 用甲装置过滤时,需不断搅拌
B. 用乙装置将Br-氧化为Br2
C. 丙装置中用正十二烷而不用CCl4,是因为其密度小
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2
查看答案和解析>>
科目: 来源: 题型:
【题目】一种钾离子电池的工作原理如图所示,下列说法正确的是
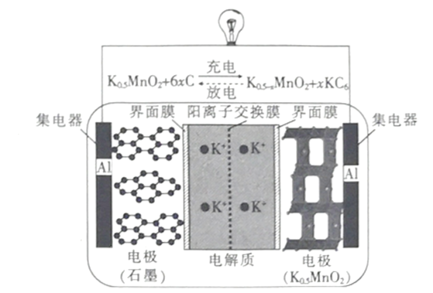
A.放电时,负极的电极反应式 :KC6 –e- =K ++6C
B.充电时,阳极的电极反应式 :K0.5-xMnO2+xK++ xe-=K0.5MnO2
C.放电时,K+ 通过阳离子交换膜向石墨电极移动
D.若仅把钾离子换成锂离子,当负极减少的质量相同时,钾离子电池转移的电子数比锂离子电池的多
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)c·xH2O]制备需要的CuCl2可用Fe3+作催化剂得到,其催化原理如图所示. 下列有关说法正确的是

A.a、b、c 之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.若制备1 mol的CuCl2,理论上消耗11.2 LO2
D.N参加的反应离子方程式为:4Fe2++ O2+ 4H+ = 4Fe3+ + 2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向Fe( NO3)2 与KSCN 组成的混合溶液中滴入少量稀盐酸 | 溶液颜色不变 |
B | 向稀溴水中通入足量 SO2气体 | 溶液的橙色逐渐褪去,最终为无色溶液 |
C | 向新制氯水中加入少量石灰石 | 溶液的浅黄绿色逐渐褪去 |
D | 将打磨光亮的铝片放置在酒精灯外焰上加热 | 铝片逐渐熔化但不滴落 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com