
科目: 来源: 题型:
【题目】下列有关苯甲酸苯甲酯( )的说法正确的是( )
)的说法正确的是( )
A.能发生取代反应和加成反应B.所有的碳原子不可能共平面
C.1mol该物质完全燃烧需要17molO2D.其一氯代物有4种
查看答案和解析>>
科目: 来源: 题型:
【题目】为检验淀粉水解的情况,进行如图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6min,试管乙不加热。
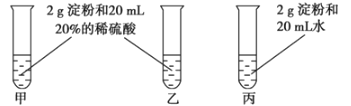
待试管甲中的溶液冷却后再进行后续实验。
实验①:取少量甲中溶液,加入新制氢氧化铜,加热,没有砖红色沉淀出现。
实验②:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液不变蓝色。
实验③:取少量丙中溶液加入氢氧化钠溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
(1)写出淀粉水解的化学方程式_____________________。
(2)设计甲和乙是为了探究________对淀粉水解的影响,设计甲和丙是为了探究________对淀粉水解的影响。
(3)实验①失败的原因是_____________________________。
(4)实验③中溶液的颜色无明显变化的原因是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氧化二砷(As2O3)可用于治疗急性早幼粒白血病。利用某酸性含砷废水(含![]() 、H+、
、H+、![]() )可提取三氧化二砷,提取工艺流程如下:
)可提取三氧化二砷,提取工艺流程如下:
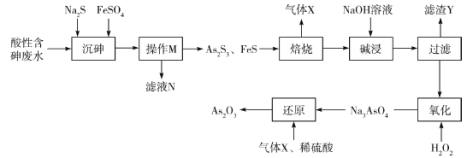
已知:①常温下,![]() ;
;![]() 。
。
②As2O3+6NaOH=2Na3AsO3+3H2O。
③As2S3易溶于过量的Na2S溶液中,故加入FeSO4的目的是除去过量的S2-。
回答下列问题:
(1)操作M的名称是________,滤液N中含有的阳离子有Fe2+、H+、________。
(2)“焙烧”操作中,As2S3参与反应的化学方程式为____________。
(3)“碱浸”的目的是_____________,“滤渣Y”的主要成分是_____________(写化学式)。
(4)“氧化”中发生反应的离子方程式为___________________。
(5)该流程中可循环使用的物质是_________(写化学式),某次“还原”过程中制得了1.98kgAs2O3,则消耗标准状况下该物质的体积是________L。
(6)溶液中金属离子的除去方法之一是Na2S沉降法。常温下,若某溶液中含Fe2+、Ag+,且浓度均为0.1mol·L-1,则向该溶液中滴加稀Na2S溶液时,先生成的沉淀是________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组用下列装置进行乙醇催化氧化的实验。已知:乙醛可被氧化为乙酸。
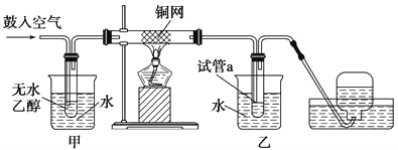
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式__________________ 、_____________________。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是____________ 反应。进一步研究表明,鼓入空气的速率与反应体系的温度关系曲线如图所示。
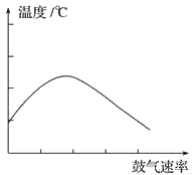
试解释出现图中现象的原因_______________________。
(3)甲和乙两个水浴作用不相同。甲的作用是_______________;乙的作用是______________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_______。要除去该物质,可在混合液中加入________ (填写字母)。然后,再通过________________(填实验操作名称)即可除去。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
查看答案和解析>>
科目: 来源: 题型:
【题目】利用煤化工所得的苯可合成甲苯、乙苯、环己烷,其反应如下:
①![]() +CH3Cl
+CH3Cl![]() (甲苯)+HCl
(甲苯)+HCl
②CH2===CH2+![]()
![]() (乙苯)
(乙苯)
③![]() +3H2
+3H2![]()
下列说法正确的是( )
A.反应①、②、③均属于加成反应
B.溴水中加入苯,二者可发生取代反应
C.乙苯中所有碳原子一定在同一平面上
D.能用溴水判断反应②所得的乙苯中是否混有乙烯
查看答案和解析>>
科目: 来源: 题型:
【题目】正常人心脏在一次搏动中泵出血液约80 mL,正常人血压(可看作心脏压送血液的压强)平均值为1.6×104Pa,心跳每分钟约70次。设人类消耗体内的葡萄糖产生的热量最高可有80%(睡眠时)用来维持心脏的跳动,葡萄糖与氧气反应产生热量的化学方程式为:C6H12O6(s)+6O2(g)―→6CO2(g)+6H2O(g)(放出热量2804 kJ)
(1)心脏工作的平均功率约为______________;
(2)由于心脏跳动每天需消耗葡萄糖的质量是____________________________;
(3)维持生命每天需消耗氧气的体积是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
下列说法正确的是
A.ΔH1<0,ΔH2>0
B.反应①②③的反应热满足关系:ΔH1-ΔH2=ΔH3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取降温措施
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡1.8倍,下列叙述正确的是
A.平衡向正反应方向移动B.A的转化率变大
C.D的物质的量变多D.a<c+d
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对化学平衡移动的分析中,正确的是
A.平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动
B.已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率降低
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率降低
C.有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
D.有气体参加的反应达到平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰硫酸(NOSO4H)纯品为棱形结晶,溶于硫酸,遇水易分解,常用于制染料。制备NOSO4H的反应原理为:![]() 、
、![]() 。
。
(1)亚硝酰硫酸(NOSO4H)的制备。
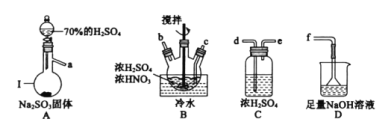
①仪器Ⅰ的名称为_________。
②按气流从左到右的顺序,上述仪器的连接顺序为____(填仪器接口字母,部分仪器可重复使用)。
③为了控制B中通入SO2的速率,可以采取的措施是_____。
④NOSO4H遇水分解的化学方程式为______,若去掉装置C会使NOSO4H的产量____(填“增大”、“减少”或“无影响”)。
(2)亚硝酰硫酸(NOSO4H)纯度的测定。
准确称取1.337g产品加入250mL碘量瓶中,加入60.00mL浓度为0.1000mol·L-1KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1Na2C2O4标准溶液滴定,消耗Na2C2O4溶液的体积20.00mL。
己知:ⅰ. ![]() + NOSO4H+
+ NOSO4H+ ![]() 、 +
、 + ![]() +
+ ![]() +
+ ![]()
ⅱ.![]()
①完成反应ⅰ的离子方程式:
____![]() +____
+____![]() ____
____![]() ____+____
____+____![]() +____
+____![]() +____
+____![]()
②滴定终点的现象为________。
③产品的纯度为_____%(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com