
科目: 来源: 题型:
【题目】某芳香烃的结构简式如图所示:

回答下列问题:
(1)该烃的分子式是__;
(2)该烃中含有四面体结构的碳原子数为__;
(3)可能在同一平面的碳原子数最多为_。
查看答案和解析>>
科目: 来源: 题型:
【题目】某烧碱样品含有少量不与酸作用的杂质,为了滴定其纯度,进行以下滴定操作:
A.在天平上准确称取烧碱样品10g,在烧杯中用蒸馏水溶解
B.用移液管(或碱式滴定管)量取25mL烧碱溶液于锥形瓶中滴加几滴酚酞作指示剂
C.在1000mL的容量瓶中配制1000mL烧碱溶液
D.将物质的量浓度为0.5 mol/L的标准硫酸溶液装入酸式滴定管,调整液面记下开始读数为V1mL
E.在锥形瓶下一张白纸,滴定至红色刚好消失为止,记下读数V2mL
回答下列问题:
(1)正确操作步骤的顺序是(填字母): → → → → E。__
(2)滴定前俯视或滴定后仰视 _____ 滴定接近终点时,有少量蒸馏水冲洗锥形瓶内壁 _____(填“偏高”、“偏低”或“无影响”)
(3)操作E中的锥形瓶下垫一张白纸的作用是___________________________。
(4)开始时标准液在滴定管刻度线以上,未予调整 ____(填“偏高”“偏低”或“无影响”)
(5)滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失______未用标准液润洗滴定管_____(填“偏高”、“偏低”或“无影响”)
(6)该烧碱样品纯度为: ____________ 。(样品中烧碱的质量/样品的质量×100%)
查看答案和解析>>
科目: 来源: 题型:
【题目】50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
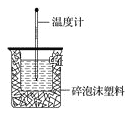
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______________,烧杯间填满碎泡沫塑料的作用是_________________。
(2)向盐酸中倒入NaOH溶液的正确操作是:________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)大烧杯上如果不盖硬纸板,则求得的中和热 ________(填“偏大”、“偏小”或“无影响”)。
(4)两次实验记录的数据如下表:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50mL 0.55mol/L NaOH溶液 | 50mL 0.5mol/L HCl溶液 | 20℃ | 23.3℃ | |
② | 50mL 0.55mol/L NaOH溶液 | 50mL 0.5mol/L HCl溶液 | 20℃ | 23.4℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ/(℃·kg),各溶液的密度均为1g/cm3。则中和热ΔH=_________kJ·mol-1。
(5)若改用60mL 0.50mol·L-1 盐酸和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”“不相等”),若实验操作均正确,则所求中和热__________(填“相等”“不相等”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g)![]() 2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是______%(保留整数)。
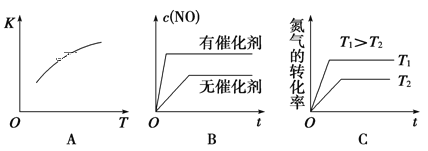
(2)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应__________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 _______。将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 ________(填字母序号)。
(3)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数_______(填“变大、“变小”或“不变)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示为800℃时A、B、C三种气体在容积不变的密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是

A.2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
B.混合气体的密度不再改变的状态为平衡状态
C.前2min A的分解速率为0.1molL-1min-1
D.达平衡后,若减小压强,平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应2NO2(g) ![]() 2NO(g)+O2(g)在容积不变的密闭容器中进行,达到平衡状态的标志是
2NO(g)+O2(g)在容积不变的密闭容器中进行,达到平衡状态的标志是
A.单位时间消耗1mol O2,同时生成2mol NO
B.混合气体的NO2和NO物质的量浓度相等
C.混合气体的密度不再改变的状态
D.用NO2、NO的物质的量浓度变化表示的反应速率的比为1∶1的状态
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,A(g)+3B(g)![]() 5C(g) ΔH>0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是
5C(g) ΔH>0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是

A.加入适当催化剂B.增大压强C.增大反应物的浓度D.升高温度
查看答案和解析>>
科目: 来源: 题型:
【题目】已知热化学方程式:H2O(g)=H2(g)+![]() O2(g) △H= +241.8kJ/mol,H2(g)+
O2(g) △H= +241.8kJ/mol,H2(g)+![]() O2(g)=H2O(1) △H= -285.8kJ/mol
O2(g)=H2O(1) △H= -285.8kJ/mol
当1g水蒸气变为液态水时,其焓变为
A.△H= +4.4kJ/molB.△H= -4.4kJ/mol
C.△H= -2.44kJ/molD.△H= +2.44kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】已知1mol H2完全燃烧生成水蒸气放出热量242kJ,且H2中1mol H-H键断裂时吸收热量436kJ,水蒸气中形成1mol H-O键时放出热量463 kJ,则O2中1mol O=O键断裂时吸收的热量为
A.556 kJB.496 kJC.336 kJD.188 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知2C(s)+2O2(g)=2CO2(g) ΔH=a kJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=b kJ·mol-1,则a>b
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH= -57.3 kJ·mol-1,则含1mol NaOH的稀溶液与足量稀醋酸完全中和,放出的热量等于57.3kJ
C.已知P(白磷,s)=P(红磷,s) ΔH<0,则白磷比红磷稳定
D.已知H2(g)+I2(g)![]() 2HI(g) ΔH= -a kJ·mol-1向密闭容器中加入2mol H2和2mol I2(g),充分反应后放出的热量小于2a kJ
2HI(g) ΔH= -a kJ·mol-1向密闭容器中加入2mol H2和2mol I2(g),充分反应后放出的热量小于2a kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com