
科目: 来源: 题型:
【题目】孔雀石的主要成分为CuCO3·Cu(OH)2设计从孔雀石中冶炼铜的方案如下:
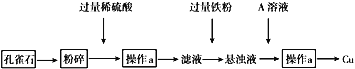
(1)将孔雀石粉碎的目的是_______,加入过量稀硫酸,可观察到的现象是_______
(2)操作a的名称是_______,在滤液中加入过量铁粉发生的反应有___________(用离子方程式表示)
(3)在悬浊液中加入A的目的是______________
查看答案和解析>>
科目: 来源: 题型:
【题目】(14分)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式: 。
(2)在海洋循环中,通过下图所示的途径固碳。

①写出钙化作用的离子方程式: 。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整: + ===(CH2O)x+x18O2+xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的还说中吹出CO2并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。

②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymlHCl溶液,海水中溶解无机碳的浓度= mol/L。
(4)利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

①结合方程式简述提取CO2的原理: 。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。
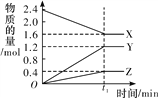
(1)请写出该反应的化学方程式:_____________________________。
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
科目: 来源: 题型:
【题目】将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即产生电流,称为甲烷燃料电池。已知甲烷燃料电池两个电极上的反应分别为CH4-8e-+10OH-=CO32-+7H2O,2O2+8e-+4H2O=8OH-。下列有关说法中错误的是( )
A.CH4在负极上反应,O2在正极上反应
B.放电过程中电解质溶液的碱性减弱
C.此电池属于环境友好型电池
D.此电池中化学能100%转化为电能
查看答案和解析>>
科目: 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___。
(2)25℃、101kPa若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量___。
(3)25℃、101kPa已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___。
(4)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O | C | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=___kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=___kJ·mol-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)═H2O(l) △H=﹣285.8kJmol﹣1
O2(g)═H2O(l) △H=﹣285.8kJmol﹣1
②H2(g)+![]() O2(g)═H2O(g) △H=﹣241.8kJmol﹣1
O2(g)═H2O(g) △H=﹣241.8kJmol﹣1
③C(s)+![]() O2(g)═CO(g) △H=﹣110.5kJmol﹣1
O2(g)═CO(g) △H=﹣110.5kJmol﹣1
④CO2(g)═C(s)+O2(g) △H=+393.5kJmol﹣1
回答下列各问题:
(1)上述反应中属于放热反应的是___。
(2)H2的燃烧热为___;C的燃烧热为___。
(3)燃烧10gH2生成液态水,放出的热量为___。
(4)CO燃烧的热化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生发应,CO2(g)+3H2(g)CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
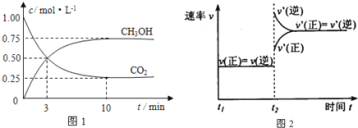
(1)从反应开始到平衡,氢气的平均反应速率υ(H2)=___。500℃达平衡时,CH3OH(g)的体积分数为___,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为___反应(填“放热”或“吸热”)。
(2)下列措施中不能使CO2的转化率增大的是___。
A.在原容器中再充入1molH2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂
E.将水蒸气从体系中分离出
(3)下列措施能使n(CH3OH)/n(CO2)增大的是___。
A.升高温度 B.恒容充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
E.恒压充入1molHe
查看答案和解析>>
科目: 来源: 题型:
【题目】全世界每年因生锈损失的钢铁,约占世界年产量的十分之一。一种钢铁锈蚀原理示意图如右,下列说法不正确的是

A. 缺氧区:Fe-2e-=== Fe2+
B. 富氧区:O2 + 2H2O + 4e-=== 4OH-
C. Fe失去的电子通过电解质溶液传递给O2
D. 隔绝氧气或电解质溶液均可有效防止铁生锈
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示:
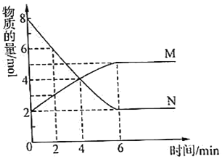
(1)反应的化学方程式为___。
(2)反应达到最大限度的时间是__min,该时间内的平均反应速率υ(N)=__。
(3)反应达到平衡状态时,放出6QkJ的热量。若容器开始时充入lmolN,反应放出的热量为__。
A.等于QkJ B.小于QkJ C.大于QkJ D.等于2QkJ
(4)判断该反应达到平衡状态的依据是___。
①该条件下,正逆反应速率都为零
②该条件下,混合气体的平均摩尔质量不再发生变化
③该条件下,混合气体的压强不再发生变化
④该条件下,单位时间内消耗2mol N的同时,生成1mol M
(5)能加快反应速率的措施是___。
①升高温度 ②容器体积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar ④使用催化剂
(6)一定温度下,将一定量的N2和H2充入2L固定体积的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g)。若起始时向容器中充入10mol的N2和15mol的H2,10min时达到平衡,测得容器内NH3的浓度为2molL﹣1。10min时N2的转化率为___;平衡时的压强和起始时的压强之比为___。
2NH3(g)。若起始时向容器中充入10mol的N2和15mol的H2,10min时达到平衡,测得容器内NH3的浓度为2molL﹣1。10min时N2的转化率为___;平衡时的压强和起始时的压强之比为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】中国科学院科研团队研究发现,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如下。下列说法不正确的是( )
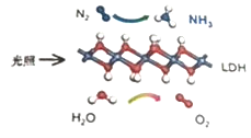
A.该过程将太阳能转化成为化学能
B.该过程中,只涉及到极性键的断裂与生成
C.氧化剂与还原剂的物质的量之比为1:3
D.原料气N2可通过分离液态空气获得
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com