
科目: 来源: 题型:
【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝绿色 | 有无色气泡产生 |
以下结论不正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中发生的反应是离子反应
D.Ⅲ中发生反应的离子方程式为2H++Zn=Zn2++H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是( )
A.基态Cr原子有6个未成对电子
B.PH3和NH3分子中均含有孤电子对,且PH3提供孤电子对的能力强于NH3
C.BeO的晶格能大于MgO,可推测BeCO3的分解温度低于MgCO3
D.向1mol配合物![]() 中加入足量AgNO3溶液,可以得到3molAgCl沉淀
中加入足量AgNO3溶液,可以得到3molAgCl沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】某硝酸厂处理尾气中NO的方法是在催化剂存在下,用H2将NO还原为N2,其热化学方程式为NO(g)+H2(g)=![]() N2(g)+H2O(g) ΔH=mkJ·mol-1,其能量变化过程如图:
N2(g)+H2O(g) ΔH=mkJ·mol-1,其能量变化过程如图:
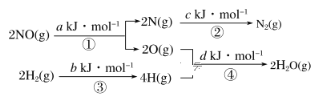
下列说法正确的是( )
A.过程①、②、③、④都是放热过程B.m=+![]() (a+b-c-d)kJ·mol-1
(a+b-c-d)kJ·mol-1
C.m=-![]() (c+a-d-b)kJ·mol-1D.m=+
(c+a-d-b)kJ·mol-1D.m=+![]() (c+d-a-b) kJ·mol-1
(c+d-a-b) kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某同学设计的放热反应的观察装置,

其实验操作步骤如下:
①按图所示将实验装置连接好;
②在U形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;
③在盛有1.0g氧化钙的小试管里滴入2 mL左右的蒸馏水,观察现象。
试回答:
(1)实验前必须进行的一步实验操作是_______________。
(2)实验中观察到的现象是______________________________________________________________。
(3)实验中发生的化学反应方程式:____________________________。
(4)说明CaO、H2O的能量与Ca(OH)2的能量之间的关系:_______________________________________。
(5)若该实验中CaO换成NaCl,实验还能否观察到相同现象?____(填“能”或“否”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】随着现代工业的快速发展,SO2烟气的排放量急剧增加。将SO2还原为硫磺是目前烟气脱硫研究的热点。根据SO2的反应状态,将SO2还原法分为气相还原法和液相还原法。
Ⅰ.气相还原法—固体还原剂直接还原法
固体还原剂直接还原法是指在一定温度下(200℃~300℃)将SO2烟气通过固体还原剂,使SO2中的氧原子转移到固体还原剂上,从而实现SO2的还原,其流程如下:
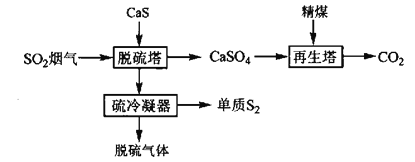
(1)再生塔中生成的物质______(填化学式)可在流程中循环使用。
(2)脱硫塔中发生反应的化学方程式为________。脱硫过程中,当产生48g单质S2时,转移电子的物质的量为______mol。
Ⅱ.液相还原法—液相催化歧化制硫法
V.M Petrusevski等人用![]() 作为催化剂,在常温下,将NaHSO3进行液相催化回收硫磺的工艺如下:
作为催化剂,在常温下,将NaHSO3进行液相催化回收硫磺的工艺如下:
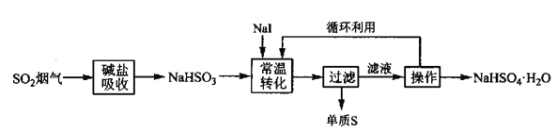
(3)下列仪器中,“操作”时不需要用到的是______(填标号)。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
(4)![]() 催化NaHSO3的反应过程为①_________(用离子方程式表示);②
催化NaHSO3的反应过程为①_________(用离子方程式表示);②![]() 。
。
(5)液相催化歧化制硫法具有反应条件温和、运行费用低等优点,然而其缺点是硫磺的回收率不会高于______%(保留1位小数)。
(6)若采用Na2S溶液作为碱盐吸收液,随着吸收液pH的变化,会生成二次污染物______(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下表:
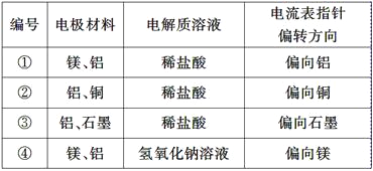
试根据表中的实验现象完成下列问题:
(1)实验①、②中铝所作的电极(指正极或负极)________(填“相同”或“不相同”)。
(2)实验③中铝为________极,电极反应式为_________________________________________;石墨为________极,电极反应式为______________;电池总反应式为____________________。
(3)实验④中铝作负极还是正极?____________,理由是_________________________,铝电极的电极反应式为__________________________________________________________。
(4)根据实验结果总结出影响铝在原电池中作正极或负极的因素为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,
计算a=_______。
(2)反应达到平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的百分含量(体积分数)为25%。计算:平衡时NH3的物质的量为_____________。
(3)原混合气体与平衡混合气体的总物质的量之比
n(始): n(平)=____________。
(4)原混合气体中a : b=_______________。
(5)达到平衡时,N2和H2的转化率![]() (N2):
(N2):![]() (H2)=______________。
(H2)=______________。
(6)平衡混合气体中n(N2): n(H2): n(NH3)=______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米Fe3O4在磁流体、催化剂、医学等领域具有广阔的应用前景。氧化共沉淀制备纳米Fe3O4的方法如下:
I.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到 FeO( OH)红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生灰白色沉淀,该反应的离子方程式是 _____________。
②上述反应完成后,测得a值与FeO(OH)产率及其生成后溶液pH的关系,结果如下:
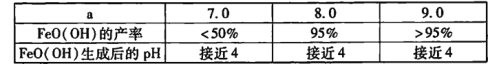
用离子方程式解释FeO( OH)生成后溶液pH下降的原因:____。
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2 O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeO( OH)向Fe2 O3的转化;
ii.溶液中存在少量Fe2+,导致FeO( OH)向Fe2O3的转化。
①经分析,假设i不成立的实验依据是____。
②其他条件相同时,向FeO( OH)浊液中加入不同浓度Fe2+,30 min后测定物质的组成,结果如下:
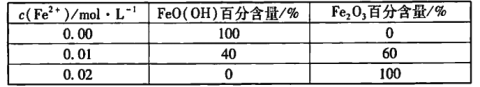
以上结果表明:____。
③ a=7和a =9时,FeO( OH)产率差异很大的原因是____。
Ⅱ.Fe2+和Fe3+共沉淀:向FeO( OH)红棕色悬浊液中同时加入FeSO4溶液和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3O4。
(3)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是____。
②已知N=n[FeO(OH)]/n(Fe2+),其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如下图所示:

经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的二氧化硫和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2![]() 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)__________________。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比____。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是多少?______
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、硫的含量影响钢铁性能.碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定.
(1)采用如图装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2.
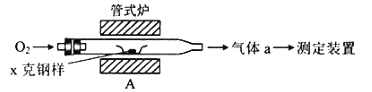
①气体a的成分是_____.
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2![]() 1_____+3_____.
1_____+3_____.
(2)将气体a通入测硫酸装置中(如图),采用滴定法测定硫的含量.
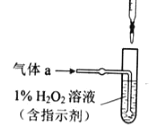
①H2O2氧化SO2的化学方程式:_____
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液.若消耗1mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:_____.
(3)将气体a通入测碳装置中(如图),采用重量法测定碳的含量.
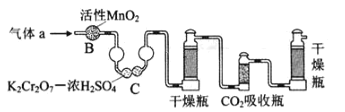
①气体a通过B和C的目的是_____
②计算钢样中碳的质量分数,应测量的数据是_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com