
科目: 来源: 题型:
【题目】如图所示三套实验装置,分别回答下列问题.
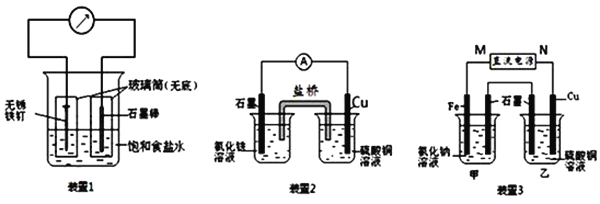
(1)装置1为铁的吸氧腐蚀实验.向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为______.
(2)装置2中的石墨是______极(填“正”或“负”),该装置发生的总反应的离子方程式为______.
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①电源的M端为______极;甲烧杯中铁电极的电极反应为______.
②乙烧杯中电解反应的离子方程式为______.
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为______mL.
查看答案和解析>>
科目: 来源: 题型:
【题目】按如图所示装置进行实验,填写有关现象及化学方程式。
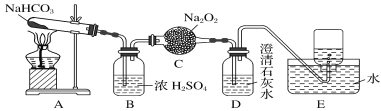
(1) D装置的作用是________,E中收集的气体是___________ (填名称)。
(2) 浓硫酸的作用是 _____________。
(3) A中发生反应的化学方程式为____________。
(4) C中发生反应的化学方程式为_________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛及其化合物应用广泛。
(1)(钛元素基态原子核外最外层电子的自旋状态___(填“相同”或“相反”)。
(2)已知一定条件下TiO2与TiCl4之间可以相互转化:TiO2![]() TiCl4。
TiCl4。
①Ti、Cl、O三种元素电负性由大到小的顺序为___。
②COCl2的分子构型为___,键角大小比较∠Cl—C—O___∠C1—C—Cl(填“>”或“<”),σ键和π键数目之比为___。
③已知室温下TiCl4为无色易溶于乙醇的液体,则TiCl4的晶体类型为___。
(3)配合物[TiCl(H2O)5]Cl2·H2O中,中心离子的配位数是___,向1mol该配合物中加入足量AgNO3溶液,可以得到___molAgCl沉淀。
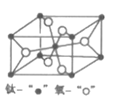
(4)金红石型TiO2的晶胞(α=β=γ=90o)如图所示:TiO2晶体中O原子的配位数是___,其晶胞参数为:a=b=459pm,c=295pm,该晶体密度为___g/cm3(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}(相对分子质量:288)可由乳酸与FeCO3反应制得,它易溶于水,几乎不溶于乙醇,受热易分解,是一种很好的补铁剂。
Ⅰ.制备碳酸亚铁:装置如图所示。
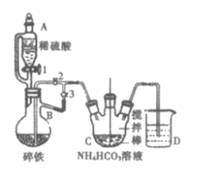
(1)仪器B的名称是___。
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是___,然后打开活塞2,关闭活塞___。
Ⅱ.制备乳酸亚铁:向纯净的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)该反应化学方程式为___。为防止乳酸亚铁变质,在上述体系中还应加入___,反应结束后,从所得溶液中获得乳酸亚铁晶体的步骤如下,请将前四步正确排序(写字母序号):___,干燥。
a.过滤 b.隔绝空气,加热 c.冷却结晶 d.用适量乙醇洗涤
Ⅲ.乳酸亚铁晶体纯度的测量;
(4)用K2Cr2O7滴定法测定样晶中Fe2+的含量计算样品纯度,称取6.00g样品配制成250.00mL溶液。取25.00mL用0.0100mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为___(以质量分数表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.lmol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是__________
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(2)取10mL乙溶液,加入等体积水,醋酸的电离平衡___________(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体 (假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___________(填“增大”“ 减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙) (填“>”、“ <”或“=”)。
(4)已知25℃时,两种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数K1 | 1.8×l1-5 | 4.3×l0-7 | 3.0×10-8 |
K2 | - - | 5.6×10-11 | - - |
下列四种离子结合H+能力最强的是___________;
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=___________;取99mL甲溶液与lrnLlmol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究SO2、NOx等大气污染物的要善处理具有重要意义。
(1)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g)对煤进行脱硫处理。某温度下,测得反应在不同时间点各物质的浓度如下:
2CaSO4(s)+2CO2(g)对煤进行脱硫处理。某温度下,测得反应在不同时间点各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.78 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.44 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(SO2)=___mol/(L·min)。
②30min后,只改变某—条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是___(填字母)。
A.移除部分CaSO4(s) B.通入一定量的O2
C.加入合适的催化剂 D.适当缩小容器的体积
(2)利用活性炭吸附汽车尾气中的NO:C(s)+2NO(g)![]() N2(g)+CO2(g),实验测得,v正=k正c2(NO),v逆=k逆c(N2) c(CO2)(k正、k逆为速率常数,只与温度有关)。在密闭容器中加入足量C(s)和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g),实验测得,v正=k正c2(NO),v逆=k逆c(N2) c(CO2)(k正、k逆为速率常数,只与温度有关)。在密闭容器中加入足量C(s)和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
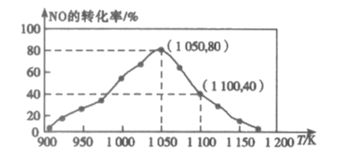
①由图可知:该反应的ΔH___0(填“>”或“<”);在1050K前反应中NO的转化率随温度升高而增大,其原因为___。
②用某物质的平街分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,计算该反应的化学平衡常数Kp=___[已知:气体分压(P分)=气体总压(P×体积分数]。
③达到平衡后,仅升高温度,k正增大的倍数___(填“>”、“<”或“=”)k逆增大的倍数,1100K时,计算k正:k逆=___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知六种物质:①H2O ②氨水③ Mg ④ HNO3 ⑤Ba(OH)2 ⑥CuSO4·5H2O
根据上述提供的物质,回答下列问题:
(1)属于电解质的是________(填序号,下同)。
(2)上述物质中④与⑤反应的离子方程式为_________。
(3)实验室配制900mL 0.1mol/L硫酸铜溶液,需要称取的溶质(从上述物质中选取)的质量为________g。在配制过程中,若其它操作均正确,则下列操作会使所配溶液物质的量浓度偏低的是_________(填字母序号)。
A 溶解后小烧杯、玻璃棒没有洗涤
B 所用容量瓶中,已有少量蒸馏水
C 定容摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线
D 定容时俯视刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
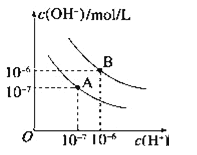
(1)95℃时水的离子积KW=_____.
(2)95℃时,0.01mol/LNaOH溶液的PH=_____.
(3)95℃时水的电离平衡曲线应为___(填“A”或“B”),请说明理由______________________.
(4)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______.
(5)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可采用CH3OH![]() CO+2H2的方法来制取高纯度的CO和H2。我国科研人员通过计算机模拟,研究了在钯基催化剂表面甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用标注。下列说法正确的是( )
CO+2H2的方法来制取高纯度的CO和H2。我国科研人员通过计算机模拟,研究了在钯基催化剂表面甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用标注。下列说法正确的是( )
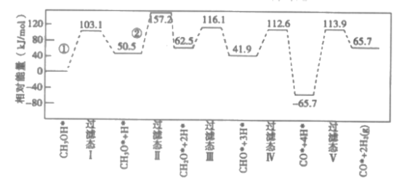
已知:甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式Ⅰ:CH3OH*→CH3O*+H* Ea=+103.1 kJ·mol-1
方式Ⅱ:CH3OH*→CH3*+OH* Eb=+249.3 kJ·mol-1
A.CH3OH*→CO*+2H2(g)的ΔH>0
B.①②都为O-H键的断裂过程
C.由活化能E值推测,甲醇裂解过程主要历经的方式应为Ⅱ
D.放热最多阶段的化学方程式为CHO*+3H*→CO*+4H*
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,在20 mL0.1 mol·L-1一元弱酸HA溶液中滴加0.1 mol·L-1NaOH溶液,溶液中lg![]() 与pH关系如图所示。下列说法正确的是( )
与pH关系如图所示。下列说法正确的是( )
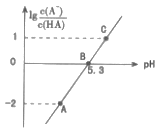
A.25℃时,HA酸的电离常数为1.0×10-5.3
B.A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
C.B点对应的NaOH溶液体积为10 mL
D.对C点溶液加热(不考虑挥发),则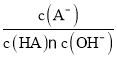 一定减小
一定减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com