
科目: 来源: 题型:
【题目】把18.0 mol·L-1的浓硫酸稀释成1.80 mol·L-1的稀硫酸100 mL,实验操作如下:
(1)请在下列操作步骤中填写有关的空格:
①用量筒量取________ mL的18.0 mol·L-1的浓硫酸;
②将__________沿烧杯内壁慢慢注入盛有少量__________的烧杯中;
③将已冷却至室温的硫酸溶液沿玻璃棒注入________ mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线__________处;
⑥改用__________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(2)由于操作不当,会引起实验误差。下列情况对所配制的H2SO4溶液的物质的量浓度有何影响?(用“偏大”“偏小”或“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水__________;
②摇匀后,发现溶液的液面低于刻度线,又加水至刻度线__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车排放的尾气是大气污染气体之一。如何减少污染气体的排放是科学家研究的热门课题。请回答下列问题:
(1)已知:CO的燃烧热为283.0kJ·mol-1,N2(g)+2O2(g)![]() 2NO2(g) ΔH= +64kJ·mol-1,则NO2(g)+2CO(g)=
2NO2(g) ΔH= +64kJ·mol-1,则NO2(g)+2CO(g)=![]() N2(g)+2CO2(g) ΔH=____kJ·mol-1,若该反应中有14g还原剂发生反应,则转移电子___mol。
N2(g)+2CO2(g) ΔH=____kJ·mol-1,若该反应中有14g还原剂发生反应,则转移电子___mol。
(2)使汽车排放的CO和NO在一定条件下发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6mol NO、8mol CO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6mol NO、8mol CO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
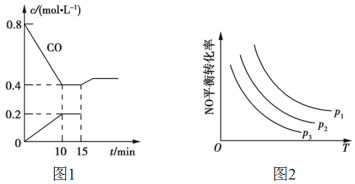
①该反应的化学平衡常数K=___。NO的平衡转化率=____。
②15min时,若改变反应条件,导致CO浓度发生如图1所示的变化,则改变的条件可能是___(填标号)。
a.缩小容器体积 b.增加CO2的量 c.体积不变通入少量氩气 d.加入催化剂
③当NO与CO的起始浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图2所示,则下列说法正确的是____ (填标号)。
A.该反应ΔH<0
B.p1<p2<p3
C.升高温度正反应速率减小,逆反应速率增大
D.温度不变,增大压强,平衡常数增大
④以下说法中能判断反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)达到平衡的是____(填标号)。
N2(g)+2CO2(g)达到平衡的是____(填标号)。
A.反应物和生成物的物质的量相等
B.单位时间内生成1mol NO同时生成1mol CO2
C.混合气体压强不再发生变化
D.NO的浓度不再变化
⑤向反应容器中再分别充入下列气体,能使NO转化率增大的是____(填标号)。
A.O2 B.N2 C.CO D.NO
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出___(填外部因素)的改变对化学反应速率的影响,其中V1=____、T1=____;通过实验___(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=____。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___。
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是____,相应的粒子最可能是___(填粒子符号)。
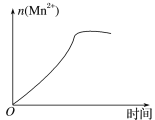
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NaHCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。
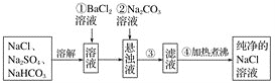
如果此方案正确,那么:
(1)操作①为什么不用硝酸钡溶液,其理由是___________________________________。
(2)进行操作①后,如何判断SO![]() 已除尽,方法是___________________________。
已除尽,方法是___________________________。
(3)操作②的目的是________,为什么不先过滤后加碳酸钠溶液?理由是________________________________________________________________________。
(4)操作③用到的玻璃仪器除烧杯、玻璃棒外,还需要____________________。
(5)操作④的目的是______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.利用键长及键能的数据可判断:稳定性![]()
B.金属的电子气理论,可以解释金属易导电易腐蚀的原因
C.化学反应过程中一定有化学键的变化,这是反应过程中能量变化的本质原因
D.活化能越大就代表化学反应需要吸收或放出的能量就越大
查看答案和解析>>
科目: 来源: 题型:
【题目】天津属于沿海城市,下列与海洋有关说法正确的是( )
A.从海水中提取![]() 单质,最后一步电解
单质,最后一步电解![]() 饱和溶液,就可制得金属镁
饱和溶液,就可制得金属镁
B.海水经过一定生产过程可以制造出杀灭病毒的84消毒液
C.从海带中提取碘,含![]() 的溶液可以用酒精萃取
的溶液可以用酒精萃取
D.海水中富集的元素氯在目前已知的元素中电负性最强
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,X、Y、Z在一个容积为2L的密闭容器中反应,这三种物质的物质的量随时间的变化曲线如图所示。
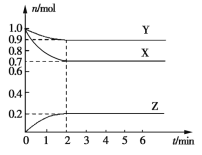
根据图中数据回答下列问题:
(1)该反应的化学方程式为____。
(2)在前2min内,气体Z的化学反应速率为___。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的___倍;
②若此时将容器的容积减小为原来的![]() ,再次达到平衡时,容器内温度升高(容器不与外界进行热交换),则该反应的正反应为____(填“放热”或“吸热”)反应。
,再次达到平衡时,容器内温度升高(容器不与外界进行热交换),则该反应的正反应为____(填“放热”或“吸热”)反应。
(4)若上述反应在第2min后的t1~t6内反应速率与反应时间的关系如下,在每一时刻均只改变一个条件,则____。
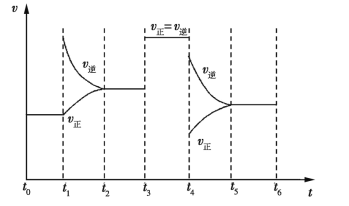
A.在t1时增大了压强 B.在t3时加入了催化剂
C.在t4时降低了温度 D.在t2~t3时X的转化率最高
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:
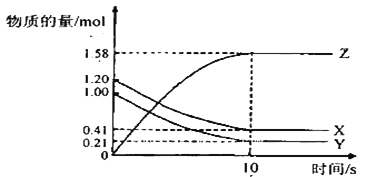
下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com