
科目: 来源: 题型:
【题目】在50 mL 4 mol·L-1的氢氧化钠溶液中,通入一定量的硫化氢,反应完毕,在常温减压条件下,用氮气把溶液吹干,得到白色固体7.92 g,通过计算确定白色固体的组成及各组分的质量。_________________
查看答案和解析>>
科目: 来源: 题型:
【题目】将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)=0.3 mol/L。试计算:(本题无计算过程不给分)
(1)反应过程中放出的气体在标准状况下的体积(不考虑气体在溶液中的溶解)。______
(2)溶液稀释后,c(H+)是多少?__________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时,H2SO3的电离常数Ka1=1.23![]() 10-2,Ka2=5.6
10-2,Ka2=5.6![]() 10-8,HClO的电离常数Ka=2.98
10-8,HClO的电离常数Ka=2.98![]() 10-8,下列说法错误的是
10-8,下列说法错误的是
A.常温下,相同浓度的H2SO3 比HClO酸性强
B.常温下,将NaHSO3溶液滴入到NaClO溶液中不发生化学反应
C.常温下,NaHSO3溶液中HSO3-的电离程度大于其水解程度,NaHSO3溶液呈酸性
D.将pH=5的HClO溶液加水稀释到pH=6时,溶液中部分离子浓度会升高
查看答案和解析>>
科目: 来源: 题型:
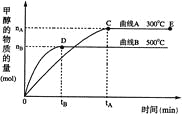
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb和的HX溶液与NH3·H2O溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是( )
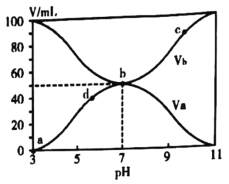
A.HX为弱酸
B.b点:![]()
C.b→c点过程中存在:![]()
D.c、d两点: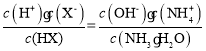 值相等
值相等
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇,
(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是 ( )
CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是 ( )
A. 反应达到平衡时,平衡常数表达式 K=c(CH3OH)/c(CO)·c2(H2)
B. 升高温度,K值增大
C. 在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=3tB/2nBmol·(L·min)-1
D. 其他条件不变,E点的体积压缩到原来的1/2,重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应 2NO2(g) ![]() N2O4(g) △H <0,升高温度该反应平衡常数增大
N2O4(g) △H <0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数互为倒数
D. CO2+H2![]() CO+H2O 的平衡常数表达式为 K =c(CO)/[c(CO2)c(H2)]
CO+H2O 的平衡常数表达式为 K =c(CO)/[c(CO2)c(H2)]
查看答案和解析>>
科目: 来源: 题型:
【题目】在一恒温、恒容的密闭容器中存在化学平衡:H2(g)+I2(g) ![]() 2HI(g),已知H2和I2的起始浓度均为0.10molL-1,达到平衡状态时HI的浓度为0.16molL-1。若H2和I2的起始浓度均变为0.20molL-1,则平衡时H2的浓度为( )
2HI(g),已知H2和I2的起始浓度均为0.10molL-1,达到平衡状态时HI的浓度为0.16molL-1。若H2和I2的起始浓度均变为0.20molL-1,则平衡时H2的浓度为( )
A. 0.16molL-1 B. 0.08 molL-1 C. 0.04 molL-1 D. 0.02molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】将充满二氧化氮和氧气的混合气体的量筒倒置于水中,充分反应后,保持气体压强不变,水进入至量筒体积的一半处停止了,则原混合气体中二氧化氮和氧气的体积比是多少?_________________
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH- △H>0,下列叙述正确的是
H++OH- △H>0,下列叙述正确的是
A. 向水中加入少量固体硫酸氢钠,c (H+)增大,Kw不变
B. 向水中加入氨水,平衡逆向移动,c (OH-)降低
C. 向水中加入金属钠,平衡逆向移动,c (H+)减小
D. 将水加热,Kw增大,pH不变
查看答案和解析>>
科目: 来源: 题型:
【题目】根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu) (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar(Cu)。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
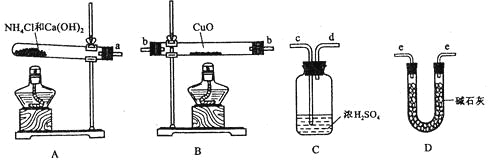
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________;
(3)在本实验中,若测得m(CuO)=ag,m(H2O)=bg,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
①CuO未完全起反应 ② CuO不干燥
③CuO中混有不反应的杂质 ④碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________和_______________,或_______________和_______________达到实验目的。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com