
科目: 来源: 题型:
【题目】如图为铝热反应的实验装置,请回答下列问题:
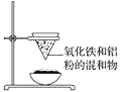
(1)该实验装置中还缺________,引发铝热反应的操作为_______。
(2)若将氧化铁换成氧化镁,该反应____(填“能”或“不能”)发生,理由是______。
(3)铝热反应的用途有哪些__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】脱除工业废气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)早期是利用NH3还原法,可将NOx还原为N2进行脱除。
已知:①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1
②N2(g)+O2(g)![]() 2NO(g) ΔH=+180kJ·mol-1
2NO(g) ΔH=+180kJ·mol-1
③H2O(g)![]() H2O(l) ΔH=-44kJ·mol-1
H2O(l) ΔH=-44kJ·mol-1
写出常温下,NH3还原NO反应的热化学方程式__。
(2)以漂粉精溶液为吸收剂可以有效脱除烟气中的NO。
①漂粉精溶液的主要成分是Ca(ClO)2,若吸收过程中,消耗的Ca(ClO)2与吸收的NO的物质的量之比为3∶4,则脱除后NO转化为__。
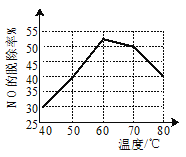
②某一兴趣小组研究不同温度下相同浓度漂粉精溶液对NO脱除率的影响,结果如图所示。图中,40~60℃NO脱除率上升可能的原因为__;60~80℃NO脱除率下降可能的原因为__。
(3)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步:NaNO2继续被氧化为NaNO3,反应为![]() +
+![]() +2OH-
+2OH-![]()
![]() +2
+2![]() +H2O。
+H2O。
不同温度下,平衡时![]() 的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示。
的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示。
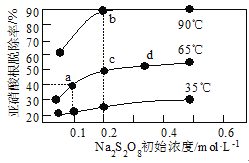
①a、b、c、d四点平衡常数K由大到小的顺序为__,原因是__。
②若a点(0.1,40%)时,![]() 的初始浓度为amol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=__。(用含a的代数式表示,已知65℃时Kw=1.0×10-13)
的初始浓度为amol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=__。(用含a的代数式表示,已知65℃时Kw=1.0×10-13)
(4)利用新型材料光催化脱除NO法如图所示。
某电化学小组将过程A、B设计成酸性电解池反应,则该反应中阴极反应方程式为___。
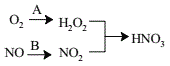
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。下列叙述正确的是( )
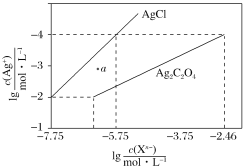
A.Ksp(Ag2C2O4)=10-7
B.a点表示的是AgCl的不饱和溶液
C.向c(Cl-)=c(C2O42-)=0.1mol·L-1的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O42-(aq)的平衡常数为109.04
2AgCl(s)+C2O42-(aq)的平衡常数为109.04
查看答案和解析>>
科目: 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。如图所示为从海带中制取碘的工艺流程。

已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为__________。
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________。
(3)下列有关步骤Y的说法中正确的是_____(填字母)。
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为____,操作Z的名称为________。
(5)方案甲中采用蒸馏不合理,理由是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为____________。
②下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)下表为某同学所测25℃时,甲、乙两种溶液的pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =___________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸反应,消耗的盐酸体积:甲_____乙。
③甲、乙溶液均加水稀释10倍后,所得溶液的pH:甲_____乙。
(3)已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度……今有HA、H2B、H3C三种弱酸,根据“较强酸 + 较弱酸盐 = 较强酸盐 + 较弱酸”的反应规律,它们之间能发生下列反应:
a.HA + HC2-(少量) = A-+ H2C-
b.H2B(少量) + 2A- = B2- + 2HA
c.H2B(少量) + H2C- = HB-+ H3C
回答下列问题:
①相同条件下,HA、H2B、H3C三种酸中,酸性最强的是_____________。
②下列反应的离子方程式正确的是____________。
A.H3C +3A- = 3HA + C3- B.HB- +A- = HA + B2-
③完成下列反应的离子方程式:
a.H3C + OH-(过量)——__________________;b.HA(过量) + C3- ——_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2SO2(g)+ O2 (g)![]() 2SO3 (g);△H=﹣197kJmol﹣1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3。恒温、恒容下反应达到平衡时,下列关系一定正确的是
2SO3 (g);△H=﹣197kJmol﹣1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3。恒温、恒容下反应达到平衡时,下列关系一定正确的是
A.容器内压强P:P甲=P丙>2P乙
B.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.SO3的质量m:m甲=m丙>2m乙
查看答案和解析>>
科目: 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是
2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是

A.a、c两点气体的平均相对分子质量:a>c
B.a、c两点气体的颜色:a深,c浅
C.由状态b到状态a,可以用加热的方法
D.a、c两点的反应速率:a>c
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是可以综合利用的。从海水中提取食盐和溴的过程如下:
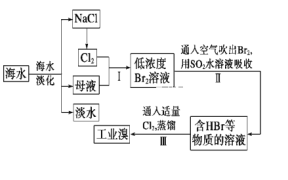
(1)请写出一种海水淡化的方法:__。
(2)步骤Ⅰ获取Br2的离子方程式为___。
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是__(填化学式)。若反应中生成2molHBr,则消耗___molSO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】标况下将8.96 L氯化氢气体溶于水形成100 mL溶液,然后与足量的铁屑反应。
(1)所得盐酸溶液的物质的量浓度是多少________?
(2)参加反应的铁的质量是多少________?
(3)标况下生成氢气的体积是多少________?
(4)将生成的氯化亚铁配成400 mL溶液,此溶液中氯化亚铁的物质的量浓度是多少________?
查看答案和解析>>
科目: 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g)![]() N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
A.该反应的平衡常数表达式K=![]()
B.达到平衡所需时间,甲与乙相等
C.平衡时NO2体积分数:甲<乙
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com