
科目: 来源: 题型:
【题目】以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)若电解食盐水时消耗NaCl的质量为234 g,则在理论上最多可得氯气的体积为________升(标准状况)。
(2)若将2 mol的氯气通入足量石灰乳中,理论上可得到次氯酸钙________克。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知热化学方程式:
①C2H2(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
②C(s)+O2(g)![]() CO2(g) ΔH2=-393.5 kJ·mol-1
CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH3=-285.8 kJ·mol-1
H2O(l) ΔH3=-285.8 kJ·mol-1
则反应④2C(s)+H2(g)![]() C2H2(g)的ΔH为( )
C2H2(g)的ΔH为( )
A. -228.2 kJ·mol-1B. +228.2 kJ·mol-1
C. +1301.0 kJ·mol-1D. +621.7 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是
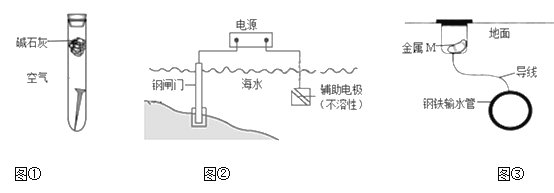
A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
C. 图②,若断开电源,钢闸门将发生吸氧腐蚀
D. 图③,若金属M比Fe活泼,可防止输水管腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】海藻中含有丰富的碘元素(以I形式存在)。实验室中提取碘的流程如下:

(1)实验操作③的名称是________,所用主要仪器名称为________。
(2)提取碘的过程中,可供选择的有机试剂是________(填序号)。
A.酒精(沸点78 ℃) B.四氯化碳(沸点77 ℃)
C.甘油(沸点290 ℃) D.苯(沸点80 ℃)
(3)在操作②中,溶液中生成少量ICl(ICl的性质类似于氯气),为消除此杂质,使碘全部游离出来,应加入适量________(填序号)溶液,反应的离子方程式___________________。
A.KIO3 B.HClO C.KI D.Br2
(4)利用碘的有机溶液得到单质I2的方法是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为铝热反应的实验装置,请回答下列问题:

(1)该实验装置中还缺________,引发铝热反应的操作为_______。
(2)若将氧化铁换成氧化镁,该反应____(填“能”或“不能”)发生,理由是______。
(3)铝热反应的用途有哪些__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现行教材中给我们介绍的“铝热反应”是用铝粉和氧化铁混合物,在镁条燃烧产生的高温下发生反应的。
(1)该反应的化学方程式为:__________________________________________________;
该反应是________(填“吸热”或“放热”)反应;以上叙述中除镁条外,还缺少一种药品,它是__________,在该反应中的作用是____________________________________________。
(2)工业冶金常用以下四法:①焦炭法;②水煤气法;③活泼金属置换法;④电解法。
用“铝热反应”原理冶炼金属锰属于_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物甲的结构如图所示。且W与X、Y、Z均可形成电子数相等的分子,![]() 常温常压下为液体。下列说法不正确的是( )
常温常压下为液体。下列说法不正确的是( )
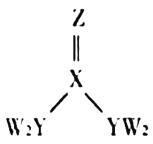
A.X、Y的简单氢化物的稳定性:![]()
B.W、Y、Z三种元素不能形成离子化合物
C.![]() 甲分子中存在
甲分子中存在![]() 键
键
D.Y元素的简单氢化物能使湿润的红色石蕊试纸变蓝
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成份是Al2O3,还含有Fe2O3、SiO2)提取氧化铝冶炼铝的原料(纯净的Al2O3),提取操作过程如下:

请回答下列问题:
(1)请写主要成份的化学式:滤渣A________,滤液丙中的溶质是NaCl和________。
(2)反应②中Al3+反应的离子方程式为_________________;反应③的离子方程式为____________;反应④的化学方程式为______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、![]() 盐酸、
盐酸、![]() 溶液,尚缺少的实验玻璃用品是____、___.
溶液,尚缺少的实验玻璃用品是____、___.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?_____(填“能”或“否”),其原因是____.
(3)实验中![]() 的浓度比
的浓度比![]() 的大,其原因是________
的大,其原因是________
(4)若用![]() 代替
代替![]() ,对测定结果________(填“有”或“无”)影响;若用醋酸代替
,对测定结果________(填“有”或“无”)影响;若用醋酸代替![]() 做实验,则测定结果________(填“偏高”“偏低”或“无影响”).
做实验,则测定结果________(填“偏高”“偏低”或“无影响”).
(5)他们记录的实验数据如下:已知:![]() ,反应后溶液的比热容
,反应后溶液的比热容![]() 为
为![]() ,各物质的密度均为
,各物质的密度均为![]() .计算完成下表_______
.计算完成下表_______
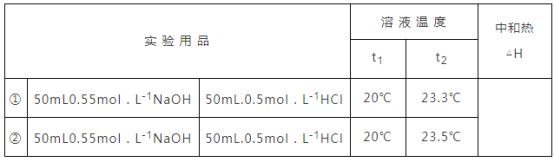
查看答案和解析>>
科目: 来源: 题型:
【题目】通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H)。
化学键 | Cl-Cl | H—H | H—Cl | N≡N |
键能/kJ·mol | 243 | 436 | 431 | 946 |
(1)按要求完成填空
a.2HCl(g) = H2(g)+Cl2(g);△H=______________________
b.N2 (g)+3H2(g)= 2NH3(g) ΔH=-92kJ/mol,则N—H键的键能是__________kJ·mol
(2)1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式__________________________________

(3) 已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2
③ H2O(g) = H2O(l) ΔH3
则CH3OH(l)+O2(g)=CO(g)+ 2H2O(l)ΔH =__________(用含ΔH1、ΔH2、ΔH3的式子表示)
(4)已知:2Al (s)+ 3/2O2(g)==Al2O3(s) △H=-1644.3 kJ mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) △H=-815.88kJ mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com