
科目: 来源: 题型:
【题目】原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、0族元素除外)( )
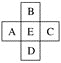
A. 4xB. 4x+14
C. 4x+10D. 4x+6
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 所在的一组是( )
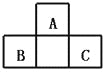
A.O、P、ClB.B、Mg、SiC.Be、Na、AlD.C、Al、P
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在某体积固定的密闭容器中加入2 mol A和1 mol B,发生可逆反应![]() ,下列说法正确的是
,下列说法正确的是
A. 当容器内压强不变时说明反应已达到平衡
B. 当反应达到平衡时:c(A):c(B):c(C)=2:1:3
C. 当反应达到平衡时放出热量akJ
D. 其他条件不变,升高温度反应速率加快
查看答案和解析>>
科目: 来源: 题型:
【题目】某制碱制得的纯碱中含有NaHCO3和NaCl杂质。某实验小组对此碱样品进行检查。
(1)取此碱样品10g,加热到质量不再减少,冷却称重,称得质量为9.845g,该样品中NaHCO3的质量分数为__________________________。
(2)另取10g固体样品,加蒸馏水溶解,配成250mL一定物质的量浓度的溶液,配制过程中必需使用的化学仪器有______________________(填字母)
A.烧杯 B.250mL容量瓶C.漏斗 D.胶头滴管 E.玻璃棒 F.试管
(3)量取上述配制好的溶液25mL,向其中加入过量盐酸至 不再产生气泡,共收集到190.4mL(标准状况)气体,该反应过程的离子方程式为______________________、_______________________。10g该样品中含____________gNaCl
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W是短周期元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。
(1)NW3的电子式为___,HWO的结构式为__,Z在元素周期表中的位置是__,XO2分子中X原子采用杂化方式___。
(2)①X、Y、Z、W原子半径由大到小依次是___(填元素符号)。
②X、Z、W最高价氧化物水化物酸性由强到弱依次是__(填化学式)。
(3)X、Y、Z、W中第一电离能最小的是___,电负性最大的是___(填元素符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知漂白粉溶于水后加入少量的酸能增强漂白效果。某同学据此将少量漂白粉溶于水后,再加入浓盐酸,观察到有黄绿色气体生成。回答下列问题:
(l)写出生成黄绿色气体的离子方程式:_________。
(2)家庭生活中常使用的“84”消毒液和某品牌洁厕净(主要成分为盐酸)____(填“能”或 “不能”)同时使用,其原因是________________
(3)现设计实验由大理石、水、氯气来制取漂白粉:大理石![]() 漂白粉溶液
漂白粉溶液![]() 漂白粉
漂白粉
①在制取漂白粉的实验过程中,请写出发生的氧化还原反应的化学方程式:____。
②当通人氯气较快时,反应产物为Ca(C1O3)2、CaCI2和H2O,请写出此反应的化学方程式:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学知识,回答下列问题:
(l)从1 L0.05 mol/L CuSO4溶液中取出10 mL,该10 mL溶液的物质的量浓度为____。
(2)现有下列5种物质:①CO2 ②Mg③盐酸④NaC1⑤Na2CO3。上述5 种物质中,属于电解质的有 ___。
(3)氢原子的物质的量相等的四种气体HCl、H2,、NH3、CH4,在同温同压下,此四种气体体积之比V(HCl):V(H2:V(NH3):V(CH4)=____。
(4)配制100 ml1.00 mol/L H2SO4溶液,需要用量筒量取浓硫酸(密度为1.84 g/cm3,溶质质量分数为98%)的体积为 ____保留一位小数)mL。
(5)反应![]() 中,若反应生成0.6 mol S,则反应中转移的电子为___ mol。
中,若反应生成0.6 mol S,则反应中转移的电子为___ mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】在1L的容器中,用纯净的CaCO3与100mL稀盐酸反应制取CO2,反应生成CO2的体积随时间的变化关系如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是( )
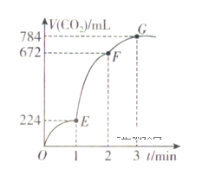
A.OE段表示的平均反应速率最快
B.G点收集到的CO2的量最多
C.EF段,用盐酸表示该反应的平均反应速率为0.04mol·L-1·min-1
D.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:
(1)在室温下,等体积、等浓度的氢氧化钠与醋酸混合后溶液呈__性,溶液中c(Na+)__c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈__性,溶液中c(Na+)___c(CH3COO-)(填“>”“=”或“<”);
(2)下列溶液,①0.1mol/L HCl溶液②0.1mol/L H2SO4溶液③0.1mol/L NaOH溶液④0.1mol/L CH3COOH溶液,按pH由小到大顺序为___。
(3)CuSO4的水溶液呈酸性的原因是(用离子方程式表示):____;实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于较浓的硫酸中,然后再用蒸馏水稀释到所需的浓度,以___(填“促进”、“抑制”)其水解。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有____,其浓度由大到小的顺序为_____,氨水的浓度a__0.01 mol·L-1(填“>”、“ <”或“=”)。
(5)已知:难溶电解质Cu(OH)2在常温下的KSP=2×10-20,则常温下:某CuSO4溶液中c(Cu2+)=0.02molL-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为____。
(6)某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:


①酸浸后加入H2O2的目的是_____________,调pH的最适宜范围为_______。
②调pH过程中加入的试剂最好是_________。
A.NaOH B.CuO C.NH3·H2O D.Cu2(OH)2CO3
③煮沸CuSO4溶液的原因是_____;向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,反应的化学方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。

(1)D中官能团名称______________________。
(2)丙烯转化为A的反应类型为___________,A转化为B的反应类型为___________。
(3)E的化学名称为______________________。
(4)丙烯聚合为F的化学方程式是_________________________________
(5)写出C与银氨溶液反应的化学方程式________________________________________。
(6)E有多种同分异构体,其中一种能发生银镜反应,且核磁共振氢谱有五组峰,则该种同分异构体的结构简式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com