
科目: 来源: 题型:
【题目】某只含铁、氧两种元素的样品A,高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,测得沉淀的质量与原样品A质量相等。如果A中只含两种物质,则A中一定含有( )
A. FeO B. Fe2O3 C. Fe3O4 D. Fe
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物M的结构简式如下,在足量NaOH水溶液中加热,然后用足量盐酸酸化后得到三种不同的有机物A、B、C,且A、B、C中所含碳原子数依次增加。回答下列问题:
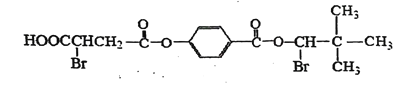
已知:同一个碳原子上结合两个羟基会自动脱水生成醛基。
(1) 1mol M加热条件下与足量的NaOH水溶液反应,消耗NaOH的物质的量为___。
(2) B中含有的官能团名称为____。
(3) C不能发生的反应类型有____。(填序号)
①加成反应②消去反应③显色反应④取代反应
(4)A在浓H2SO4作用下可生成六元环状化合物,其化学方程式为___。
(5)A的两种同分异构体E、F分别有如下特点:
①lmol E或F可以和3mol Na发生反应,放出标准状况下33.6L H2;
②lmol E或F可以和足量NaHCO3溶液反应,生成lmol CO2;
③lmol E或F可以发生银镜反应,生成2mol Ag。
则E和F的结构简式分别是_____、_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用环己醇(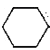 —OH)与85%磷酸在共热条件下制取环已烯(
—OH)与85%磷酸在共热条件下制取环已烯(![]() ),制备装置如图所示。
),制备装置如图所示。
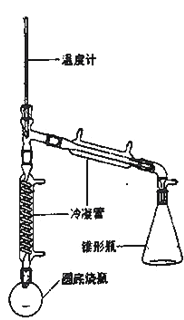
实验药品的物理性质:
名称 | 密度(g/mL) | 熔点℃ | 沸点℃ | 溶解性 |
环己醇 | 0.96 | 25.2 | 161 | 微溶于水 |
环己烯 | 0.81 | -103 | 83 | 不溶于水 |
85% H3PO4 | 1.68 | 42.35 | 213(失水) | 易溶于水 |
已知:环己醇能与水形成二元共沸物(含水80%),其沸点为97.8℃
实验原理:
(1)该实验的反应原理与实验室制乙烯相似,请用化学方程式表示______。
(2)该反应有副反应发生(产物为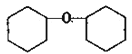 ),反应的方程式为____。
),反应的方程式为____。
II.制备粗产品:
(3)在圆底烧瓶中加入20mL(9.6g)环己醇、10mL 85% H3PO4几粒碎瓷片,用电热包均匀缓慢加热。温度计的温度不应超过90℃,原因是____;85% H3PO4在反应中的作用是____;碎瓷片的作用是_____。
Ⅲ.粗产品提纯
(4)从分液漏斗中分离出来的环己烯还要转移到蒸馏烧瓶中,并加入少量的无水氯化钙进一步蒸馏,此时温度计下端的水银球应插在蒸馏烧瓶的_____位置,温度计显示的温度应为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W是原子序数依次递增的短周期主族元素。Y、W同主族,且W的核电荷数是Y的2倍,X、Y、W三种元素原子的最外层电子数之和为17,Y与Z可形成离子化合物Z2Y和Z2Y2。
(1)Y在元素周期表中的位置为____。Z的最高价氧化物的水化物的电子式是______,存在的化学键的类型为_______。
(2)Y、Z、W的原子半径从大到小的顺序是______(用元素符号表示)。X的简单气态氢化物和W最高价氧化物的水化物反应的离子方程式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室从废定影液中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取Cl2并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如图所示。下列叙述正确的是
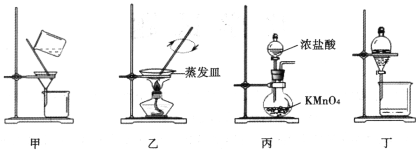
A.用装置甲分离Ag2S时,用玻璃棒不断搅拌
B.用装置乙在通风橱中高温灼烧Ag2S制取Ag
C.用装置丙制备Cl2,其中KMnO4也可用MnO2代替
D.用装置丁分液时,打开分液漏斗塞子,再打开旋塞,使下层液体从分液漏斗下端放出,待两液界面与旋塞上口相切即可关闭旋塞
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列10种有机物
①CH4 ②CH3—C![]() CH ③
CH ③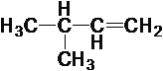 ④
④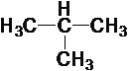 ⑤
⑤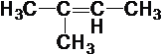 ⑥
⑥ ⑦
⑦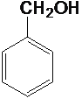 ⑧
⑧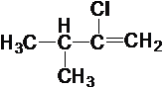 ⑨
⑨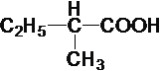 ⑩C8H18
⑩C8H18
请回答(填序号):
(1)属于炔烃的是____,属于醇类的是____。
(2)互为同系物的是____,互为同分异构体的是____。
(3)在有机物分子中,若某个碳原子上连接4个不同的原子或原子团,则这种碳原子称为“手性碳原子”。则上述有机物中含有手性碳原子的是____,本身没有手性碳原子,但通过与氢气发生加成反应,得到的有机物含有手性碳原子的是___。
(4)上述烷烃中一定不能由烯烃加成得到的是___,若⑩也不能由烯烃加成得到,则⑩的结构简式是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图所示:

(1)写出B+乙―→甲+C的化学反应方程式___________________________
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是________。(填写序号) ①A ②B ③C ④D
(3)依据下列条件可以进一步确定上述第四种元素:①甲与丙以及乙与丙均能够发生反应,②甲、丙都是无色、有刺激性气味的物质。
据此,请回答下列问题:写出上述第四种元素在周期表中第_______周期第_______族;写出C+丙―→乙+丁的化学反应方程式_________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某核素![]() 的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数为_________。
(2)若X的核内中子数为12,求47.5gXCl2中所含质子的物质的量是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于烃 的说法正确的是
的说法正确的是
A. 共面的C原子最多为14个
B. 共直线的C原子只有为4个
C. 1mol该烃最多可以和6molH2发生加成反应
D. 1mol该烃最多可以消耗6molBr2
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:
(1)有相同温度和压强下的两种气体12C18O和14N2,若两种气体的质量相同,则两种气体所含的质子数之比为__________,若两种气体的原子数相等,则两种气体所含中子数之比_________,若两种气体的体积相同,则两种气体的密度之比为_________。
(2)10.8 g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为 ________。
(3)将10 mL1.00 mol/L Na2CO3溶液与10 mL1.00 mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为___________(忽略混合前后溶液体积的变化)。
(4)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是_________。
(5)在空气中煅烧CoC2O4生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com