
科目: 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
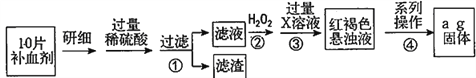
请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NOx、COx的消除和再利用对改善生态环境、构建生态文明具有重要的意义。
Ⅰ.反应N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g)△H2。
(1)已知CO的燃烧热为283.0kJ·mol-1,则△H2=___。
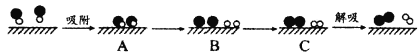
(2)某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 和
和![]() 分别表示O2、NO、N2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸过程中的能量状态最低的是__(填字母序号)。
分别表示O2、NO、N2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸过程中的能量状态最低的是__(填字母序号)。
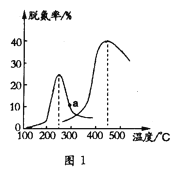
(3)另一研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内脱氮率(即NO的转化率)随温度的变化关系如图1所示。图中低于200℃,脱氮率随温度升高而变化不大的主要原因是___;a点(填“是”或“不是”)__对应温度下的平衡脱氮率,理由是__。
Ⅱ.向容积可变的密闭容器中充入1molCO和2.2molH2,在恒温恒压条件下发生反应CO(g)+2H2(g)CH3OH(g)△H<0,平衡时CO的转化率随温度、压强的变化情况如图2所示。
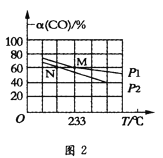
(4)反应速率:N点v正(CO)(填“大于”、“小于”或“等于”)__M点v逆(CO)。
(5)M点时,H2的转化率为__(计算结果精确到0.1%);用平衡分压代替平衡浓度计算该反应的平衡常数Kp=__(用含p1的最简表达式表达,分压=总压×物质的量分数)。
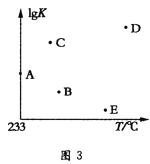
(6)不同温度下,该反应的平衡常数的对数值(lgK)如图3所示,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是___(填字母符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A.0.1molNH3中含有中含有的原子数为0.3NA
B.0.2molNaCl中含有的离子总数为0.2NA
C.9.8g H2SO4即为0.1mol H2SO4
D.1molH2O中含有2mol氢和1mol氧
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究工业制硫酸接触室中的反应,设计如图所示装置,并测定此条件下二氧化硫的转化率。
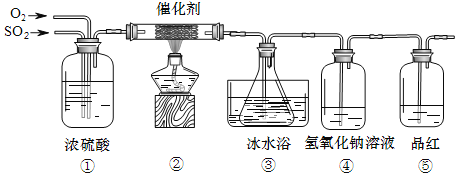
(1)①中浓硫酸的作用除了通过观察气泡,调节气体的流速外,还能_____、_____。
(2)③锥形瓶中盛放的是足量的氯化钡溶液,实验过程观察到锥形瓶中产生白色沉淀,反应的化学方程式为_____;锥形瓶浸入冰水浴的原因是_____。
(3)⑤中品红颜色没有发生改变,说明_____。
(4)若通入SO2的体积为V L(已折算为标准状况下的体积),要测定该条件下二氧化硫的转化率,实验时还需要测定的数据是m g,则m可以是_____,此条件下二氧化硫的转化率是_____(列式表示)。
(5)反应结束后还需通入N2的原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,这四种元素仅处于两个周期,其中X元素的最外层电子数是其层数的3倍,这四种元素构成的一种离子化合物的结构如图所示。下列说法正确的是( )
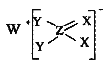
A.原子半径Y>Z>X
B.单质W在其同族元素形成的单质中熔点最低
C.Z的最高价氧化物对应的水化物是中强酸
D.该化合物中的所有元素均满足8电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】某校同学设计下列实验,探究CaS脱除烟气中的SO2并回收S。实验步骤如下:
步骤1.称取一定量的CaS放入三口烧瓶中并加入甲醇作溶剂(如下图所示)。
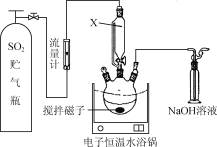
步骤2.向CaS的甲醇悬浊液中缓缓通入一定量的SO2。
步骤3.过滤,得滤液和滤渣。
步骤4.从滤液中回收甲醇(沸点为64.7 ℃),所得残渣与步骤3的滤渣合并。
步骤5.用CS2从滤渣中萃取回收单质S。
(1) 图中用仪器X代替普通分液漏斗的突出优点是________________。
(2) 三口烧瓶中生成硫和亚硫酸钙的化学方程式为________________,三口烧瓶中最后残留固体中含一定量的CaSO4,其原因是________________。
(3) 步骤4“回收甲醇”需进行的操作方法是________________。
(4) 步骤5为使滤渣中S尽可能被萃取,可采取的操作方案是________________。
(5) 请设计从上述回收的S和得到的含Na2SO3吸收液制备Na2S2O3·5H2O的实验方案:
称取稍过量硫粉放入烧杯中,__________________________________________,用滤纸吸干。
已知:① 在液体沸腾状态下,可发生反应Na2SO3+S+5H2O![]() Na2S2O3·5H2O。
Na2S2O3·5H2O。
②硫不溶于Na2SO3溶液,微溶于乙醇。
③为获得纯净产品,需要进行脱色处理。
④须使用的试剂:S、Na2SO3吸收液、乙醇、活性炭。
查看答案和解析>>
科目: 来源: 题型:
【题目】α—甲基苯乙烯(AMS)在有机合成中用途广泛,以下是用苯为原料合成AMS,并进一步制备香料龙葵醛的路线:
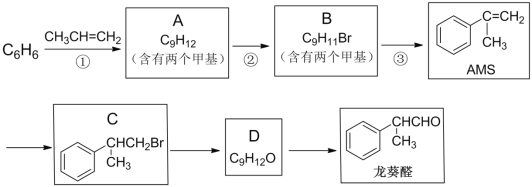
完成下列填空:
(1)反应①的反应类型是____;反应③所需的试剂与条件是____。
(2)写出反应②的化学方程式:____。
(3)AMS可以自身聚合,写出该高聚物的结构简式:____。
(4)写出同时满足下列条件的龙葵醛的一种同分异构体的结构简式:____。
i. 苯环上的一氯代物有两种
ii. 分子中没有甲基
iii. 能与金属钠产生H2
(5)有人认为仅用反应②就能得到C,事实证明产物中C的含量远远小于B。由该事实可以得到的结论是____。
(6)设计一条由AMS合成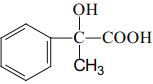 的合成路线____。(合成路线常用的表示方式为:A
的合成路线____。(合成路线常用的表示方式为:A ![]() B。。。
B。。。![]() 目标产物)
目标产物)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用碳酸钙的分解产物与足量焦炭在高温电炉中生成电石。
(1)写出该反应的方程式:_____。
(2)电石的保存需严格防水,写出电石与水反应的化学方程式:_____。
(3)写出上述反应方程式中非极性分子的结构式:_____。
(4)写出电石的电子式_____。
(5)实验室用右图制取乙炔并验证乙炔与溴水发生了加成反应。

①实验中控制反应速率的措施有_____、_____。
②小试管中可能的现象是:溴水褪色、_____。
③溴水褪色_____(“能” “不能”)证明乙炔与溴发生了加成反应,若能,说明理由,若不能, 写出修改方案_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】向20mL0.5mol·L-1的醋酸溶液中逐滴加入一定物质的量浓度的烧碱溶液,混合溶液的温度与所加NaOH溶液的体积关系如图所示。下列有关说法正确的是( )
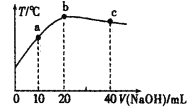
A.a点:c(CH3COOH)>c(OH-)+c(Na+)
B.醋酸的电离常数:b点<a点
C.b点:c(CH3COOH)+c(CH3COO-)=0.5mol·L-1
D.c点:n(OH-)-n(H+)-n(CH3COOH)=0.01mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com