
科目: 来源: 题型:
【题目】T℃时,在1L的密闭容器中充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是( )
CH3OH(g)+H2O(g)H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是( )
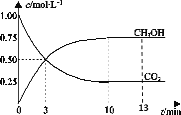
A.T℃时,平衡常数K=3,CO2与H2的平衡转化率相等
B.T℃时,上述条件下达到平衡时放出49.0kJ的热量
C.降温和缩小容器体积均可使反应的平衡常数增大
D.从反应开始到3min,H2的平均反应速率υ(H2)=0.5molL-1min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应 N2(g)+3H2(g)![]() 2NH3(g),在500℃时,将2molN2和2molH2冲入容积为10L的密闭容器中进行反应,达到平衡时,NH3不可能达到的浓度是( )
2NH3(g),在500℃时,将2molN2和2molH2冲入容积为10L的密闭容器中进行反应,达到平衡时,NH3不可能达到的浓度是( )
A.0.01mol·L-1B.0.02mol·L-1
C.0.05mol·L-1D.0.15mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】按如图所示装置进行实验,观察到灵敏电流计指针偏转,图中a、b电极均为铜单质,下列说法正确的是( )
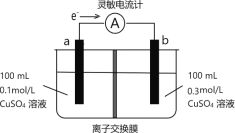
A.该装置的能量转换形式为:电能→化学能
B.b的电极反应为:Cu-2e-=Cu2+
C.溶液中SO![]() 穿过阴离子交换膜发生迁移
穿过阴离子交换膜发生迁移
D.外电路转移的电子最多为0.01mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.MgCO3![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
B.Cu2(OH)2CO3![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2
C.BrCH2COOH![]() HOCH2COOH
HOCH2COOH![]() H-[OCH2CO]n-OH
H-[OCH2CO]n-OH
D.NH3![]() NO
NO![]() HNO3
HNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列各溶液中,指定的离子组一定能大量共存的是( )
A.无色溶液中:K+、Cu2+、Cl-、SO![]()
B.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO![]()
C.在pH=1的溶液中:K+、Ba2+、Cl-、NO![]()
D.室温下,![]() =10-13的溶液中:Na+、Fe3+、NO
=10-13的溶液中:Na+、Fe3+、NO![]() 、SO
、SO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】平衡体系mA(g)+nB(g)![]() pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是( )
pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是( )
A.②④B.②③C.①④⑤D.①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】用KMnO4氧化盐酸溶液,反应方程式如2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,计算:
(1)参加反应的HCl的物质的量________________
(2)反应中被氧化的HCl的物质的量__________________
(3)并用双线桥标出电子转移的方向和数目___________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,反应mA(s)+nB(g) ![]() pC(g)+qD(g)在一密闭容器中进行,测得平均反应速率v(B)=2v(C)。若该反应过程中气体的物质的量一直保持不变,则m、n、p、q的数值可以是 ( )
pC(g)+qD(g)在一密闭容器中进行,测得平均反应速率v(B)=2v(C)。若该反应过程中气体的物质的量一直保持不变,则m、n、p、q的数值可以是 ( )
A.2、6、3、5B.3、2、1、1
C.1、1、1、1D.2、2、1、3
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确______。
②乙直接加热饱和FeCl3溶液,请评价是否正确______。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(3)写出制备Fe(OH)3胶体的化学方程式: ____________________。证明有Fe(OH)3胶体生成的实验操作是_____________________。该操作利用胶体的性质是________。
(4)Fe(OH)3胶体稳定存在的主要原因是____________________(填字母,下同)。
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是_____________,这种现象称为胶体的________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com