
科目: 来源: 题型:
【题目】微信热传的“苯宝宝表情包”可看作是由苯衍生的物质配以相应文字形成的(如图)。下列说法正确的是

A. 化合物(A)不能与乙醇发生反应
B. 化合物(B)分子式为C6H6Cl6
C. 化合物(B)可通过苯与Cl2发生加成反应制得
D. 1mol化合物(A)可与3molH2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=________kJ·mol-1。
(2)反应①的化学平衡常数K表达式为________;图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是________。
图1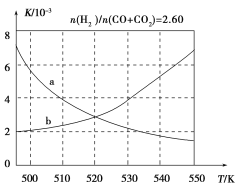
图2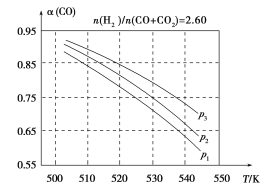
(3)合成气组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是________________________________;图2中的压强由大到小为________,其判断理由是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积为2L的恒容密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)反应在三种不同的条件下进行,反应物SO2的物质的量(mol)随反应时间(min)的变化情况如下表所示:
2SO3(g)反应在三种不同的条件下进行,反应物SO2的物质的量(mol)随反应时间(min)的变化情况如下表所示:
实验序号 | 时间 物质的量 温度 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
1 | 490℃ | 2.00 | 1.00 | 0.50 | 0.30 | 0.25 | 0.20 | 0.20 |
2 | 490℃ | 2.00 | 0.30 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
3 | 500℃ | 2.00 | 0.50 | 0.35 | 0.30 | 0.30 | 0.30 | 0.30 |
(1)对照实验1,实验2改变的某一外界条件可能是_______。
(2)反应达平衡后,向实验2中加入少量的18O2,一段时间18O后可能存在于哪些物质中________(填选项)。
A 只存在氧气 B 只存在三氧化硫 C 只存在反应物 D 存在反应物与生成物
(3)实验3中,在5~15min时段,用O2表示的平均反应速率为______ mol/(L·min)。
(4)若将实验1置于绝热体系中,测得实验到达平衡的时间比原来缩短了,则参加反应的SO2和O2的总能量______(填“>”、“<”或“=”)生成的SO3的总能量。
(5)能说明实验3达到平衡状态的标志是_______(任写一条)。
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,在元素周期表中的位置如图所示,其中W元素的原子序数为Z元素原子序数的两倍,则下列说法正确的是
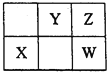
A. X位于元素周期表中的第3周期第ⅥA族
B. X、Y、Z三种元素对应原子的半径依次减小
C. XZ2和YZ2的结构和化学性质相似
D. 利用Y的含氧酸酸性强于W的含氧酸酸性,可证明非金属性W强于Y
查看答案和解析>>
科目: 来源: 题型:
【题目】下列判断正确的是( )
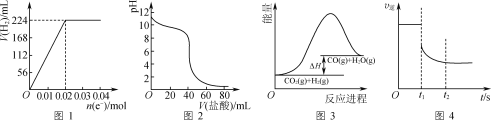
A.图1可表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线
B.图2可表示常温下0.1 mol·L-1盐酸滴加到40 mL 0.1 mol·L-1 NaOH溶液的滴定曲线
C.高温下能自发进行的反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
D.图4可表示反应N2(g)+3H2(g)![]() 2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
查看答案和解析>>
科目: 来源: 题型:
【题目】用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备锂电池的正极材料LiFePO4。部分工艺流程如下:
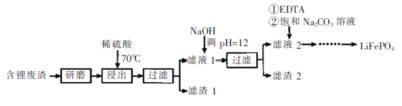
资料:i滤液1、滤液2中部分例子浓度(g·L-1)
Li+ | Ni2+ | Ca2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 0.36 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.08 | 0.78×10-3 |
ii.EDTA能和某些二价金属离子形成稳定的水溶性络合物
iii.某些物质的溶解度(S)
T/℃ | 20 | 40 | 60 | 80 | 100 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
S(Li2SO4)/g | 34.7 | 32.7 | 31.7 | 30.9 |
I.制备Li2CO3粗品
(1)上述流程中为加快化学反应速率而采取的措施是____。
(2)滤渣2的主要成分有____。
(3)向滤液2中先加入EDTA,再加入饱和Na2C03溶液,90℃充分反应后,分离出固体 Li2CO3粗品的操作是_______。
(4)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是________g。(摩尔质量:Li2CO3 74 g.mol4)
II.纯化Li2CO3粗品
(5)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO31溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是____,该池使用了_________(填“阳”或“阴”)离子交换膜。

Ⅲ.制备 LiFePO4
(6)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上,在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氢气和水,反应方程式可表示为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)
(1)一定条件下,在容积为2L的容器内进行该反应,20min时达到平衡,生成N2 0.4mol,则平均反应速率v(NO)=___________________。可从混合气体的颜色变化判断上述反应是否达到平衡,其理由是_______________________________________________。
(2)工业上也用氨水吸收SO2尾气,最终得到(NH4)2SO4,(NH4)2SO4溶液中c(NH4+)与c(SO42-)之比____2:1(选填“>”、“<”、“=”),用离子方程式解释其原因______________________。
(3)与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚铝酸钠和稀盐酸为原料制备ClO2,反应如下:NaClO2+HCl→ClO2↑+NaCl+_____(没有配平)
(4)补全方程式并配平,标出电子转移方向和数目_________________________ 。
(5)该反应中氧化剂和还原剂的物质的量之比是___________。若生成0.2molClO2,转移电子数为_____个。
查看答案和解析>>
科目: 来源: 题型:
【题目】1,2-二氯丙烷(CH2C1CHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2C1),反应原理为:
I.CH2=CHCH3(g)+C12(g)![]() CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
II.CH2=CHCH3(g)+C12(g)![]() CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2C1(g)+HC1(g)![]() CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和C12(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
②该温度下,若平衡时HC1的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() _______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
_______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
(3)某研究小组向密闭容器中充入一定量的CH2=CHCH3和C12,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2C1CHC1CH3的产率与温度的关系如下图所示。
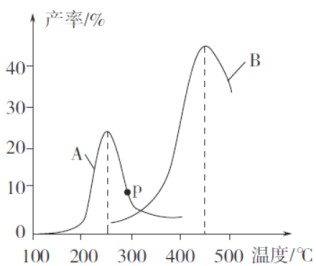
①下列说法错误的是___________(填代号)。
a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强不影响CH2C1CHC1CH3的产率
c.两种催化剂均能降低反应的活化能,但△H不变
d.提高CH2C1CHC1CH3反应选择性的关键因素是控制温度
②在催化剂A作用下,温度低于200℃时,CH2C1CHC1CH3的产率随温度升高变化不大,主要原因是_______________________________________________________________。
③p点是否为对应温度下CH2C1CHC1CH3的平衡产率,判断理由是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应N2+3H2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A. 3v正(N2)=v正(H2)B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3)D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,浓度均为1 mol·L-1的A2和B2两种气体,在密闭容器内反应生成气体C,反应达平衡后,测得:c(A2)=0.16 mol·L-1,c(B2)=0.58 mol·L-1,c(C)=0.84 mol·L-1,则该反应的正确表达式为 ( )
A.2A2+B2 ![]() 2A2BB.A2+B2
2A2BB.A2+B2 ![]() 2AB
2AB
C.A2+B2 ![]() A2B2D.A2+2B2
A2B2D.A2+2B2 ![]() 2AB2
2AB2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com