
科目: 来源: 题型:
【题目】pH=2的X、Y、Z三种酸的溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的变化关系如图所示,下列说法中正确的是
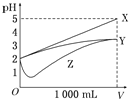
A.X是强酸,Y和Z是弱酸
B.稀释前的浓度大小为c(Y)>c(Z)>c(X)
C.稀释前电离程度大小为X>Z>Y
D.pH=2时,X、Y、Z都是稀溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生如下反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
容器 | 容器类型 | 初始体积 | 初始压强/Pa | 反应物投入量/mol | 平衡时Cl2的物质的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
I | 恒温恒容 | 1L |
| 4 | 1 | 0 | 0 | 1 |
II | 绝热恒容 | 1L | p2 | 0 | 0 | 2 | 2 | a |
III | 恒温恒压 | 2L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
A.反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105Pa,p3=4×105Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH+4):③>①B. 水电离出的c(H+):②>①C. ①和②等体积混合后的溶液:c(H+)=c(OH![]() )+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl
)+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl![]() )>c(OH
)>c(OH![]() )>c(H+)
)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).
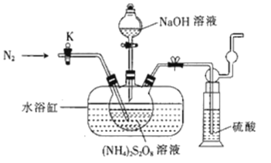
已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___,反应过程中持续通入氮气的目的是___。
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:___。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:___。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
①在___(填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为___。
③若用0.1molL-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为___ g(用含V1的代数式表示,5H2O2~2![]() )。
)。
查看答案和解析>>
科目: 来源: 题型:
【题目】光气(COCl2)在农药、医药、工程塑料等方面都有广泛应用,光气常温下为无色气,有腐草味,低温时为黄绿色液体,化学性质不稳定,遇水迅速水解,生成氯化氢。某实验小组利用如下实验装置合成光气并利用光气与浓氨水反应制备尿素[CO(NH2)2]。主要实验装置(夹持装置略去)及操作步骤如下:
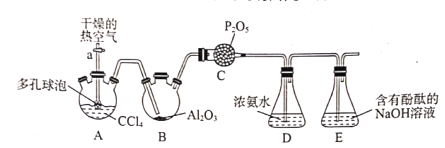
①按如图连接装置,检验装置的气密性,然后加装实验药品;
②打开活塞a.,向A中缓慢通入干燥的热空气;
③一段时间后,装置D中溶液会出现分层现象,且混合液上方有大量白色烟雾;
已知:3CC14+Al2O3=3COCl2+2AlC13
回答下列问题:
(1)检验整个装置的气密性的方法:___。
(2)步骤②中通入干燥的热空气的作用为___。
(3)装置C的作用___。
(4)装置D中反应除生成尿素[CO(NH2)2]外,还有NH4Cl生成,该反应的化学方程式为___。。
(5)分离装置D中混合液的操作名称为___。
(6)装置E中足量的NaOH溶液与少量的光气反应的离子方程式为:___。
(7)实验后,将D中溶液先蒸发结晶,再用重结晶的方法得到尿素晶体(含有少量的NH4Cl杂质),测定所得晶体中尿素的百分含量的方法:将7.07g晶体中所含氮完全转化为氨气所得氨气用100mL2.00molL-1的硫酸溶液完全吸收,取吸收液10mL用0.4000molL-1的氢氧化钠标准溶液滴定。
①到达滴定终点时,消耗氢氧化钠45.00mL,则该晶体中尿素的质量分数为___(保留3位有效数字)。
②若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得该体晶中尿素的质量分数___(选填“偏大”或“偏小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关.
(1)下列生活用品中,其主要材料属于天然纤维的是_________(填字母序号);
A.塑料保鲜薄 B.橡胶手套 C.棉布围裙
(2)我们常用的洗涤剂清洗餐具上的油污,这是因为洗涤剂具有_________的功能;
(3)食用水果、蔬菜主要补充人体所需的_________;
(4)国家禁止在面粉中添加增白剂过氧化钙CaO2,过氧化钙中氧元素的化合价为_______;
(5)农业上降低土壤酸性的是_________(填化学式);
(6)生活中要用到大量的钢铁,写出赤铁矿(主要成分Fe2O3)冶炼成铁的化学方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋中有丰富的“食品、矿产、能源、药物和水产资源”等,下列说法正确的是

A.第①步中除去泥沙及Ca2+、Mg2+等杂质时,不涉及化学变化过程
B.工业上,通过电解“精盐”水溶液可以制取金属钠
C.第②步的反应条件是“在空气中直接加热”
D.第③、④、⑤步中均涉及氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O 三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
(5)某FexNy的晶胞如题21图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如题21图-2 所示,其中更稳定的Cu替代型产物的化学式为___________。

查看答案和解析>>
科目: 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是( )
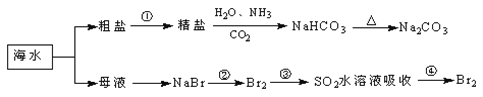
A. 除去粗盐中杂质(Mg2+、SO42﹣、Ca2+),加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤后加盐酸
B. 用澄清的石灰水不可鉴别NaHCO3和Na2CO3
C. 在第②、④步骤中,溴元素均被氧化
D. 从第②步到第④步的目的是为了富集
查看答案和解析>>
科目: 来源: 题型:
【题目】将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道,其合成反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。回答下列问题:
CH3OH(g)+H2O(g)。回答下列问题:
(1)如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa和5.0MPa。据图可知,该反应为_______________反应(填“放热”或“吸热")。设CO2的初始浓度为comolL-1,根据5.0MPa时的数据计算该反应的平衡常数K(240k)=_______________ (列出计算式即可)。若在4.0MPa时减小投料比,则CO2的平衡转化率曲线可能位于II线的_______________(填“上方”或“下方”)。

(2)利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/k.Jmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=_______________k.Jmol-1 。
(3)已知:①CO(g)+NO2(g)![]() CO2(g)+NO(g) △H1=-226kJrnol-1
CO2(g)+NO(g) △H1=-226kJrnol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H2=+68kJmol-1
2NO2(g)△H2=+68kJmol-1
③N2(g)+O2(g)![]() 2NO(g) △H3=+183kJmol-1
2NO(g) △H3=+183kJmol-1
则:2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H=_______________kJmol-1。
2CO2(g)+N2(g) △H=_______________kJmol-1。
(4)一定温度下,下列措施一定能加快反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
A.及时移去甲醇 B.改进催化剂 C.提高反应物浓度 D.增大容器压强
(5)甲烷重整可选氧化物NiO- Al2O3作为催化剂,工业上常用Ni(NO3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com